au sommaire
Les atomes vus comme d'immenses vides, cela peut être vrai du point de vue des particules qui les composent, mais ce n'est qu'un point de vue : leur volume intérieur est rempli de champs de forces électriques et magnétiques, si puissants qu'ils vous bloqueraient tout de suite si vous essayiez d'y entrer. Ce sont ces forces qui assurent la solidité de la matière, quand bien même les atomes semblent « pleins de vide ». Alors que vous lisez ces lignes, assis, vous êtes suspendu à une épaisseur d'atome au-dessus des atomes de votre chaise, grâce à ces forces...
L'atome est loin d'être vide. Le noyau est la source de puissants champs électriques qui baignent cet espace par ailleurs « vide », à l'intérieur de l'atome. La découverte date de 1906. Ernest RutherfordErnest Rutherford avait remarqué que lorsqu'un faisceau de particules alpha, chargées positivement, traversait de fines feuilles de mica, on observait une image floue sur une plaque photographique, ce qui suggérait que les particules étaient diffusées par le mica, et déviées de leurs lignes de vol.
Ernest Rutherford, les champs électriques et les particules alpha
C'était une surprise, car les particules alpha allaient à 15.000 kilomètres par seconde, soit un vingtième de la vitesse de la lumière, et avaient une énorme énergieénergie, rapportée à leur taille. De puissants champs électriques ou magnétiques pouvaient les dévier légèrement, mais n'étaient rien en comparaison avec ce que produisait ce passage dans quelques micromètresmicromètres (millionièmes de mètres) de mica.
Rutherford calcula que les champs électriques à l'intérieur du mica devaient être extraordinairement puissants, en comparaison avec ce qui était alors connu. Dans l'airair, des champs de cette intensité crépiteraient d'étincelles, et la seule explication qu'il put imaginer fut que ces puissants champs ne devaient exister que dans des volumes extrêmement petits, plus petits même qu'un atome. À partir de cela, il eut une intuition visionnaire : ce sont ces champs électriques intenses qui retiennent les électronsélectrons dans leurs prisons atomiques, et qui peuvent dévier les alpha si rapides.
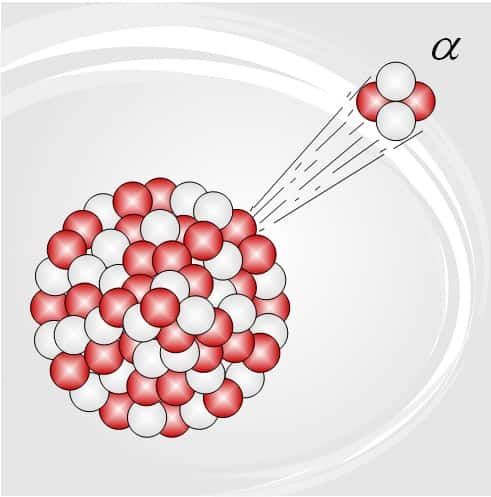
En 1909, Rutherford confia à Ernest Marsden, un jeune étudiant, la tâche de regarder si des rayons alpha n'étaient pas déviés à très grand angle. Marsden utilisa une feuille d'or plutôt que de mica, et un écran scintillant pour détecter les particules alpha diffusées. Il pouvait déplacer cet écran non seulement derrière la feuille d'or, mais aussi sur les côtés, et même tout autour, jusqu'à proximité de la source radioactive elle-même. Ainsi, il pouvait détecter les alpha réfléchis à grands-angles.
À la surprise générale, Marsden découvrit qu'une particule sur 20.000 rebondissait directement dans la direction d'où elle venait, et allait frapper l'écran quand celui-ci se trouvait près de la source. C'était un résultat incroyable. Les particules alpha, qui étaient à peine sensibles aux forces électriques les plus puissantes alors connues, pouvaient être renvoyées d'où elles venaient par une mince feuille d'or dont l'épaisseur ne dépassait pas quelques centaines d'atomes ! Pas étonnant que Rutherford se soit exclamé : « C'était comme si vous tiriez un obus de 15 pouces sur une mince feuille de papier de soie, qu'il rebondissait et vous revenait dans la figure ».

Après des mois d'efforts pour comprendre ces observations, Rutherford vit enfin comment les interpréter, au moyen d'un calcul très simple. La clé en fut la connaissance qu'il avait de l'énergie des alpha incidents. Il savait aussi que chaque alpha portait deux charges positives. La charge positive à l'intérieur de l'atome d'or devait repousser les alpha qui s'en approchaient, les ralentissant et les écartant de leurs trajectoires. Plus les alpha s'approchaient de la charge positive de l'atome, plus ils étaient déviés, jusqu'aux cas extrêmes où ils étaient arrêtés et renvoyés sur leurs traces.
Rutherford put ainsi calculer à quelle distance de la charge positive les alpha devaient s'approcher, et le résultat le stupéfia. Dans quelques cas rares, la particule alpha s'approchait jusqu'à un millionième de millionième de centimètre du centre de l'atome, soit un dix-millième du rayon de l'atome, avant de rebondir. Cela montrait que la charge positive était concentrée tout au centre de l'atome, laissant une image de l'atome « vide » de particules, mais rempli de champs électriques.