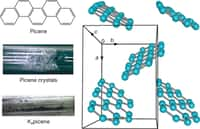
au sommaire
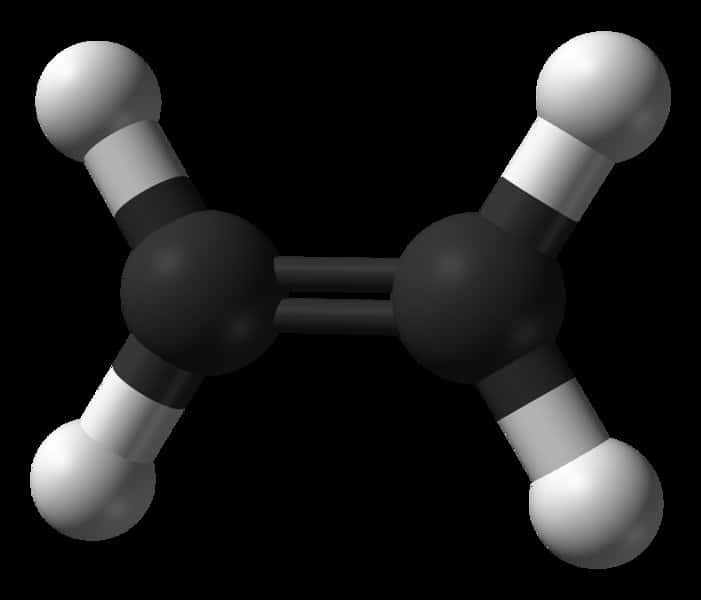
Une représentation de la molécule d'éthylène. On remarque les deux atomes de carbone (en noir), maintenus par leur double liaison, et les quatre atomes d'hydrogène (en blanc). La double liaison peut laisser place à une simple liaison, chaque atome de carbone pouvant alors se lier à un autre atome ou une autre molécule. C'est ainsi que l'on peut polymériser l'éthylène en accrochant les molécules les unes aux autres. © Domaine public
L'éthylène (ou éthène) est un hydrocarbure à deux atomes de carbone, de formule C2H4, ou plus précisément CH2=CH2 (avec une double liaison entre les deux atomes de carbone, C).
Avec ses deux atomes de carbone, il se range aux côtés de l'éthane (CH3-CH3)) et de l'éthanol (CH3-CH2OH, l'alcool des boissons). Avec sa double liaison C=C, c'est un alcène, et le plus simple d'entre eux puisqu'il n'y a qu'une liaison. C'est un hydrocarbure insaturé car il peut libérer la moitié de cette double liaison pour se lier à d'autres atomes ou moléculesmolécules.
L'éthylène est un gazgaz très réactifréactif. On l'obtient classiquement par craquage du pétrolepétrole. Utilisé dans de nombreux domaines, c'est la molécule organique la plus produite au monde. Par exemple, sa polymérisationpolymérisation produit le polyéthylènepolyéthylène (PETPET), une matière plastiquematière plastique très commune.