au sommaire
La virulence des virus influenza A
La virulence est la capacité pour un microorganismemicroorganisme de pénétrer dans un organisme hôte, de s'y multiplier, avec pour conséquence le développement d'une maladie. Elle dépend de l'interaction entre le virus et ses composants, avec un type de cellule, un tissu spécifique ou un organisme entier ; cette association de facteurs lui permettant de se répliquer et de disséminer au sein de l'organisme hôte.

Le virus de la grippe aviaire. © DR
Les oiseaux sauvages sont les hôtes naturels des virus influenzainfluenza A. Régulièrement, ces virus infectent les populations d'oiseaux domestiques, et le passage des virus A de la faunefaune sauvage à la volaille industrielle s'accompagne du développement d'une virulence chez les nouveaux hôtes. Les facteurs qui contribuent à l'apparition de cette virulence sont difficilement reproductibles en laboratoire, et sont vraisemblablement multiples. Un certain nombre de déterminants moléculaires de la virulence ont été identifiés :
Le rôle des protéines HA et NA
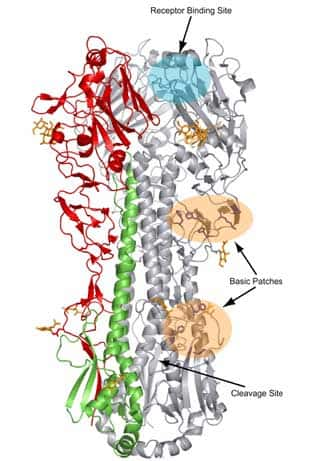
La protéineprotéine HA intervient dans la fusion du virus avec la membrane endosomale cellulaire. La fusion nécessite que l'HA soit activée et pour cela clivée en deux sous-unitéssous-unités HA1 et HA2. L'extrémité N terminale de HA2 assure la fusion avec la cellule. Le clivageclivage de l'hémagglutininehémagglutinine est une condition préalable à l'initiation de l'infection et donc un facteur déterminant de la virulence du virus.
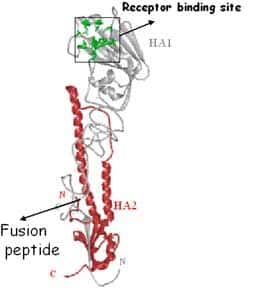
Les deux sous-unités de l'hémagglutinine. © Weis et al., 1990, Biophysical Journal
Les virus H1, H2, H3 contiennent un seul acide aminéacide aminé, l'argininearginine, au site de clivage. Le clivage est assuré par des protéasesprotéases extracellulaires sécrétées par un seul type de cellule (chez l'homme, les cellules de l'épithéliumépithélium respiratoire). Les souches hautement pathogènespathogènes H5N1 et H7, présentent de multiples acides aminés basiques adjacents au site de clivage (Puthavathana, Auewarakul et al. 2005 43)) (Govorkova, Rehg et al. 2005 20) (Perdue, Suarez et al. 2000 42). La présence de ces acides aminés permet le clivage de l'HA par des protéases intracellulaires ubiquitaires telles la furine ; en conséquence, le processus de clivage est plus efficace et peut s'effectuer dans un grand nombre de cellules (Horimoto and Kawaoka 1994 24).
Selon le nombre et le type d'acides aminés présents au niveau du site de clivage, on identifie des souches virales avirulentes ou peu pathogènes et des souches virales hautement pathogènes. Une substitution de la sérinesérine vers l'isoleucineisoleucine, au niveau de la position 227 de l'HA, diminue la virulence de la souche hautement pathogène isolée chez l'homme à Hong Kong en 1997 (Hatta, Peng et al. 2001 21). Un minimum de cinq acides aminés à proximité d'un hydrate de carbone est nécessaire pour un clivage optimal et le remplacement de l'arginine par la lysinelysine à l'extrémité C terminale de HA1 inhibe la clivabilité de HA (Walker and Kawaoka 1993 60). Les virus recombinants H5N1 ne possédant pas ces acides aminés basiques ne sont pas virulents chez la souris (Hatta, Peng et al. 2001 21). Leur présence atteste donc de l'importance de cette caractéristique de l'hémagglutinine dans la manifestation de la virulence des virus influenza A.
Cependant, l'intensité de la virulence peut être modulée par la présence d'acides aminés au niveau de régions différentes de l'hémagglutinine des virus A (H5N1). La présence de séquence polybasique au site de clivage n'est pas toujours associée à la virulence, la composition du site de clivage et l'existence d'un résidu acide ayant une influence sur le phénotypephénotype pathogène du virus (Hulse, Webster et al. 2004 2).
L'hémagglutinine du virus de la grippevirus de la grippe espagnole de 1918 ne présente pas de site de clivage polybasique ; les souches humaines peu virulentes dont il est issu ont pourtant généré un virus hautement pathogène ; on ignore quelle caractéristique lui confère une telle virulence (Kobasa, Takada et al. 2004 30).
La neuraminidaseneuraminidase joue également un rôle dans l'activation de l'hémagglutinine. La présence d'un site de glycosylation supplémentaire au niveau de la structure globulaireglobulaire de NA du virus H5N1virus H5N1 augmente la virulence de celui-ci chez le poulet, peut-être par une augmentation de l'activation des protéases de la cellule hôte (Hulse, Webster et al. 2004 25). Le raccourcissement de la longueur de la tige de l'enzyme, les mutations à son niveau seraient des facteurs de la manifestation de la virulence chez l'homme (Zambon 2001 62). L'évolution de souches aviaires peu pathogènes vers des souches hautement pathogènes s'accompagne d'une succession de mutations au niveau du gènegène de la neuraminidase (Banks, Speidel et al. 2001 7) (Deshpande, Naeve et al. 1985 16).
On pense qu'un équilibre est nécessaire entre les activités de l'HA et de la NA ; la force de fixation de l'HA sur la cellule hôte à la période initiale de l'infection, doit être adaptée à l'efficacité de la NA dans la libération des nouveaux virionsvirions de la surface cellulaire (Baigent and McCauley 2001 4).
Le rôle des polymérases virales
Les protéines du complexe polymérasepolymérase des virus influenza A sont impliquées dans la virulence du virus A (H5N1). Les études menées sur les souches virulentes et avirulentes isolées chez l'homme au cours de l'épidémieépidémie de Hong Kong en 1997, démontrent que le pouvoir pathogène de chacune de ces deux souches est déterminé par l'acide aminé en position 627 de la protéine PB2 ; la présence de la lysine en remplacement de la glutamineglutamine augmente la capacité réplicative du virus chez la souris (Shinya, Hamm et al. 2004 49) ; elle est sans effet sur la réplicationréplication du virus dans des cellules aviaires (Hatta, Peng et al. 2001 21).
La souche humaine hautement pathogène A/Vietnam/1203/04 (H5N1) présente la même substitution à la position 627 de PB2 (Govorkova, Rehg et al. 2005 20). L'acide aminé en position 627 jouerait un rôle dans l'interaction de la polymérase virale avec des facteurs d'hôtes spécifiques (aviaires ou mammifèresmammifères), ou déterminerait la température seuil de l'activité de l'ARN polyméraseARN polymérase virale, la réplication virale s'initiant à des températures différentes chez les oiseaux et les mammifères (Noah and Krug 2005 40).
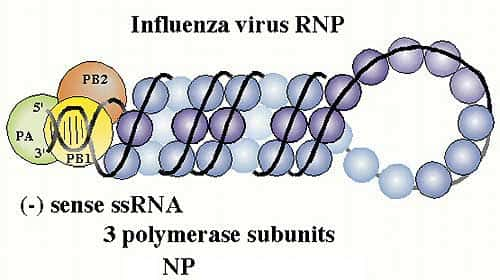
Ribonucléoprotéine virale complexée aux trois polymérases PA,PB1 et PB2. © Paul Digard, Dept Pathology, University of Cambridge
Des souches de virus A (H5N1), isolées chez des canards sains en Chine, entre 1999 et 2002, ont acquis progressivement un pouvoir pathogène et létallétal chez la souris. Par génétiquegénétique inverse on a pu démontrer qu'une mutation au niveau de l'acide aminé à la position 701 de la protéine PB2 est responsable du franchissement de la barrière d'espècesespèces et de l'acquisition de la virulence chez la souris (Li, Chen et al. 2005 35).
Le rôle de la protéine NS1
L'infection du porc par un virus recombinant H1N1 porteur du gène NS de la souche A/Hong Kong/156/97 (H5N1) est responsable d'une virémievirémie plus importante et durable que l'infection par le virus sauvage H1N1. La virulence du virus réassorti requiert l'existence d'un acide glutamiqueacide glutamique en position 92 de la protéine NS1 ; elle est interprétée comme la conséquence de la résistancerésistance du virus à l'action antivirale des interféronsinterférons et du facteur de nécrose tumorale α sécrétés par l'hôte (Seo, Hoffmann et al. 2004 48) (Seo, Hoffmann et al. 2002 4).
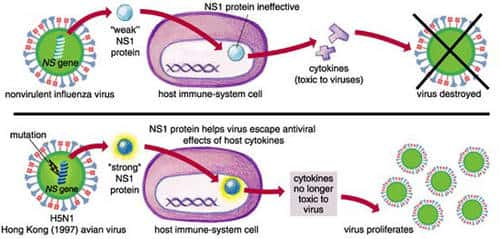
Variation génétique de la protéine NS1 et virulence. © Sigma Xi, The Scientific Research Society/Emma Skurnick
L'infection des macrophagesmacrophages dérivés de monocytesmonocytes par deux souches A/Hong Kong/97 (H5N1) isolées chez l'homme, induit une production importante de cytokinescytokines proinflammatoires (interféron β, facteur de nécrose tumorale α) comparativement à d'autres virus influenza A, H1N1 ou H3N2. Un taux élevé de cytokines circulantes contribuerait au pouvoir pathogène du virus A (H5N1) (Lipatov, Andreansky et al. 2005 37).
Le pouvoir apoptotique des virus influenza A
Les virus influenza A ont la capacité de déclencher la mort programmée de cellules en culture. L'apoptoseapoptose se caractérise par la désintégration du cytosquelettecytosquelette et la fragmentation de l'ADNADN cellulaire. Les virus grippaux de type A étant des parasitesparasites intracellulaires obligatoires, leurs fonctions apoptotiques sont efficaces à la fin de la réplication, après utilisation de la machinerie cellulaire.
Trois protéines virales seraient impliquées dans la mort cellulaire. La neuraminidase joue un rôle initiateur du processus apoptique par l'activation du facteur de croissancefacteur de croissance transformant β, à la différence de la protéine NS1A dont l'absence chez un virus recombinant augmente l'activité apoptotique de celui-ci. Ces observations corroborent l'hypothèse selon laquelle la virulence du virus A (H5N1) est en relation avec une augmentation importante des cytokines circulantes, notamment les interférons (Cheung, Poon et al. 2002 13). La troisième protéine impliquée dans l'apoptose des cellules infectées est une petite protéine de 87 acides aminés encodée par le gène PB1. Elle augmente spécifiquement l'apoptose des monocytes, limitant son action aux cellules immunitaires de l'hôte (Noah and Krug 2005 40) (Baigent and McCauley 2003 5).
La virulence des virus influenza A est plurifactorielle. Des interactions fonctionnelles sont identifiées comme déterminants au niveau moléculaire de la virulence de certains virus, notamment du virus A (H5N1). Il est envisageable que toute interaction entre les protéines d'origine virale et/ou cellulaire, qui optimise l'enveloppement des ribonucléoprotéines virales dans les particules virales et l'assemblage de nouveaux virions, facilite la dissémination virale et donc potentialise la virulence de ces virus.
La plupart des virus isolés chez les oiseaux sont avirulents, responsables d'infection asymptomatique ou peu sévère. On a pu mettre en évidence au cours d'épidémies de grippe, l'évolution de souches peu pathogènes vers des souches hautement pathogènes. Ce phénomène concerne les sous-types H5 et H7 (Banks, Speidel et al. 2001 7).
Tumpey et ses collaborateurs ont reconstruit par génétique inverse, le virus de la grippe espagnole de 1918, afin de comprendre les raisons de son extrême virulence. Les études sur des cellules épithéliales respiratoires humaines suggèrent que la présence conjointe du gène HA et des gènes de la polymérase du virus de 1918 est essentielle à une réplication optimale. La comparaison du virus de 1918 avec d'autres virus recombinants exprimant un ou plusieurs gènes du virus de la grippe espagnole démontre que ces gènes sont impliqués dans la virulence optimale de ce virus (Tumpey, Basler et al. 2005 58).
Les souches virales A (H5N1) isolées chez l'homme et les oiseaux au cours des flambées de 1997 et la période 2003-2004 montrent une augmentation de la virulence des isolats humains de 2004 chez le furet (Maines, Lu et al. 2005 38).