au sommaire
L'AFM ou comment « caresser » les protéines
La microscopie à force atomique, développée par des physiciensphysiciens en 1986, permet d'imager la surface d'un échantillon à des résolutionsrésolutions atomiques. Son principe consiste à balayer la surface de l'échantillon avec une pointe dont les déplacements sont repérés par un laser. Ces données permettent ensuite de dresser la carte « topographique » de l'échantillon.

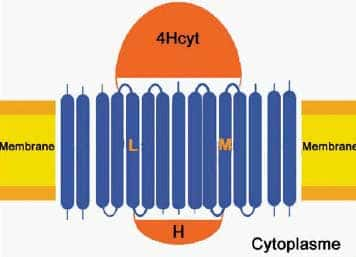
Structure du "core complex"
Composé d'un centre réactionnel (en orange) entouré de 16 collecteurs de lumière (en bleu), le core complex est une structure transmembranaire.
L'AFMAFM présente l'énorme avantage de pouvoir analyser des échantillons en solution : un atout majeur pour la biologie. Dès 1995, des protéinesprotéines membranaires ont pu être observées en AFM, à des résolutions latérales de 6 angströms (10-10m) et verticales de 1 angström. Jusqu'à présent, cette approche concernait essentiellement des protéines purifiées et reconstituées sous forme de cristaux 2D en bicouches lipidiques. Cependant, par sa précision, l'AFM permet de visualiser des protéines individuelles dans une membrane. Toute la difficulté de cette observation réside ensuite dans le fait d'approcher suffisamment la pointe de l'AFM des protéines pour recueillir le maximum d'informations sans les endommager. Un jeu tout en douceur dans lequel l'équipe de Jean-Louis Rigaud excelle. Récemment les chercheurs de l'Institut Curie ont observé le « relief » de protéines membranaires isolées sans qu'elles aient été cristallisées auparavant. Ils ont ainsi pu étudier les changements de conformationconformation liés à la perte de seulement 20 acides aminésacides aminés d'une protéine avec une précision moléculaire (de l'ordre de 10 angströms).
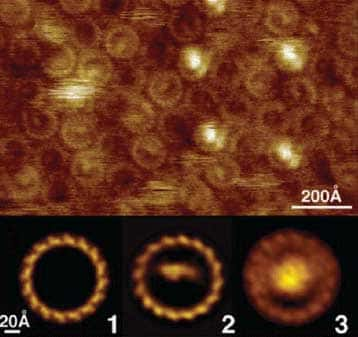
En haut : membranes de Rhodopseudomonas viridis en solution - chaque cercle représentant un core complex
En bas : la figure 3 représente le core complex entier - la figure 2 représente une sous unité (4HCyt) du centre réactionnel qui a été enlevée par nanodissection grâce à la pointe de l'AFM - sur la figure 1 le centre réactionnel a été entièrement enlevé.
L'équipe de Jean-Louis Rigaud vient de franchir une nouvelle étape en observant dans des membranes natives - c'est-à-dire très proches de leur état naturel - les collaborations entre protéines. Ce sont les premières images sur l'organisation d'un supercomplexe protéique. Les chercheurs de l'Institut Curie ne se contentent pas de regarder, ils modifient le complexe en « arrachant » spécifiquement des sous-unitéssous-unités protéiques grâce à la pointe de l'AFM. L'association de l'imagerie et de cette nanodissection permet d'obtenir une description détaillée du complexe protéique et ainsi de mieux comprendre la coopération entre les deux types de protéines présentes. Outre une meilleure compréhension de la photosynthèsephotosynthèse chez les bactériesbactéries, ces résultats montrent tout l'intérêt de l'AFM pour observer des protéines à l'échelle atomique dans des membranes natives. Grâce à l'AFM, Simon Scheuring, membre de l'équipe de Jean-Louis Rigaud, nous plonge dans l'intimité des protéines en les observant en complexe, in situ et dans des conditions physiologiques. Les chercheurs de l'Institut Curie s'intéressent dorénavant à des associations de protéines membranaires plus complexes.
C'est grâce à la combinaison de la microscopie à haute résolution comme l'AFM, de la microscopie électronique - depuis des échelles atomiques obtenues par cristallographiecristallographie jusqu'à des échelles cellulaires -, et de la microscopie optique que les cellules livreront progressivement leurs secrets.