Pour produire de l’hydrogène, l’électrolyse de l’eau apparaît comme une solution évidente. Mais l’eau pure est précieuse. Mettre au point une technologie qui permette d’employer comme base une eau de mer extrêmement abondante, serait la solution. Et c’est ce que des chercheurs américains annoncent avoir fait !
au sommaire
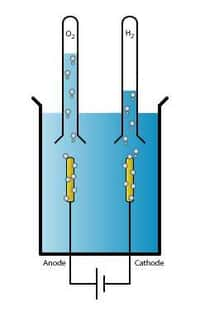
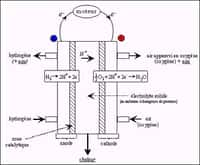
L'hydrogène est l'élément le plus abondant dans l’Univers. Pourtant, il reste rare sur Terre. Avant de pouvoir l'utiliser comme combustible vert, il faut donc produire cet hydrogène. Et c'est en théorie possible assez facilement. Un panneau solaire, des électrodes et de l'eau. C'est tout ce qu'il faut en principe pour réaliser une réaction d'électrolyse de laquelle on peut tirer de l'oxygène - du côté de l'anode - et de l'hydrogène - du côté de la cathodecathode.
Le bémol, c'est que l'eau utilisée doit être pure. Or, l'eau pure reste précieuse et coûteuse à produire. Alors des chercheurs de l'université de Stanford (États-Unis) se sont demandé s'il pouvait être possible de réaliser l'opération à partir d'une eau de mer - contenant pourtant des ionsions chlorure chargés négativement et risquant de corroder l'anode - qui apparaît, elle, extrêmement abondante sur notre planète.

Une technologie rapidement transférable
Les chercheurs ont découvert qu'en couvrant l'anode de couches riches en charges négatives, celles-ci repoussent les ions chlorure. Ils y ont donc d'abord placé une moussemousse de nickelnickel qui joue le rôle de conducteur. Puis de l'hydroxyde de nickel-ferfer qui déclenche l'électrolyse et du sulfuresulfure de nickel, couche négative qui protège l'électrode.
« Avec des courants identiques à ceux utilisés dans l'industrie, notre anode résiste plus de 1.000 heures contre seulement 12 heures pour une électrode classique plongée dans l'eau de mer », souligne Michael Kenney. La validité du procédé a été prouvée en laboratoire. Reste maintenant à transférer la technologie. Mais comme les éléments utilisés par les chercheurs de l'université de Stanford s'emploient déjà dans les électrolyseurs existants, cela pourrait être rapide.
En vidéo : bientôt le moteur à eau de mer ?
Par hasard, un retraité américain a découvert le moyen de dégager de l'hydrogène à partir d'eau salée. Curiosité de laboratoire vérifiée par un physicienphysicien de renom, cette voie inédite commence à être prise au sérieux.
Article de Jean-Luc GoudetJean-Luc Goudet paru le 14/09/2007

John Kanzius a déjà défrayé la chronique avec sa « machine à guérir le cancercancer ». Cet autodidacte de la science s'est acharné sur une méthode qui ne semble pas si farfelue, consistant à focaliser des ondes radio sur des tumeurstumeurs après avoir introduit dans le corps des nanoparticulesnanoparticules métalliques. L'élévation de température affecterait surtout les cellules cancéreuses.
C'est en testant son engin que John Kanzius a découvert... qu'elle pouvait enflammer l'eau de mer ! Voilà de quoi devenir célèbre une seconde fois... On pense de nouveau à un gag mais l'effet semble réel. L'exploit a été filmé et surtout reproduit en laboratoire. L'inventeur a reçu le soutien de Rustum Roy (de la Penn State University), un physicien connu, qui présente sur son propre site la vidéo de l'eau enflammée ainsi que les travaux de John Kanzius.
Les images sont impressionnantes : un tube à essaitube à essai contenant de l'eau salée et bouché par un rouleau de papier est introduit dans la machine et soumis aux rayonnement micro-ondes. Spontanément, une flamme jaillit et la mèche de papier flambe comme si le liquideliquide dans lequel elle baigne était de l'alcoolalcool ou un combustiblecombustible quelconque. La température atteindrait 1 650 °C.
La preuve par l'image, ou comment enflammer de l'eau de mer...
Fabriquer de l’hydrogène
Bien sûr, ce n'est pas l'eau qui s'enflamme. Selon Rustum Roy, les radiofréquences brisent les liaisons entre les moléculesmolécules d'eau et les sels présents, libérant l'hydrogène. L'explication du phénomène est loin d'être précise mais c'est bien ce gazgaz qui s'enflamme. En somme, l'expérience réalise l'équivalent d'une électrolyse, une méthode capable elle aussi de séparer l'hydrogène et d'oxygène de l'eau.
L'eau ne devient nullement un combustible puisqu'il faut de l'énergieénergie pour libérer l'hydrogène, comme dans l'électrolyse. Il en faut même beaucoup et le bilan final est de 76 %, c'est-à-dire que l'énergie récupérée sous forme d'hydrogène représente les trois quarts de l'énergie introduite pour générer les ondes radio. Ce rendement n'est qu'un peu inférieur à celui de l'électrolyse et John Kanzius ne désespère pas de faire mieux...
Mais plutôt que de le brûler directement, comme le font les expérimentateurs sur la vidéo, l'hydrogène pourrait servir à produire de l'électricité dans une pile à combustiblepile à combustible, par exemple pour alimenter le moteur électrique d'une voiturevoiture. La trouvaille de John Kanzius viendrait alors se ranger aux côtés des multiples techniques envisagées pour faire de l'hydrogène un vecteur universel d'énergie.