au sommaire
La cryotomographie électronique est une technique de microscopie électronique qui permet d'observer des échantillons biologiques à hautes résolutionsrésolutions dans un état proche de leur état naturel. L'astuce consiste à provoquer un gelgel rapide avec de l'éthane liquide à la température de l'azote liquide, afin que l'eau forme de la glace vitreuse (non cristalline). De cette manière, il est possible de limiter les dégâts causés par le faisceau d'électrons sur les structures biologiques et surtout de les observer dans un contexte proche de celui régnant dans les organismes vivants. Depuis des années déjà, on a ainsi obtenu des informations sur la structure 3D de grosses molécules biologiques, mais on cherche sans cesse à améliorer la technique.
Des chercheurs du Lawrence Berkeley National Laboratory (Berkeley Lab) travaillant au fameux centre dédié à la nanotechnologie, la Molecular Foundry, font état dans un article de Plos One de progrès accomplis dans ce domaine.
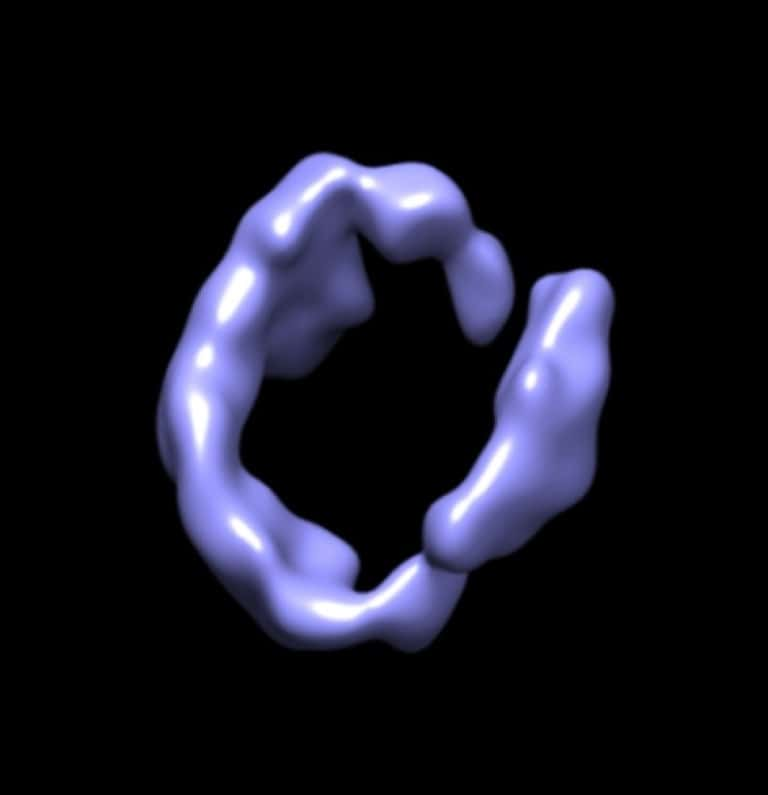
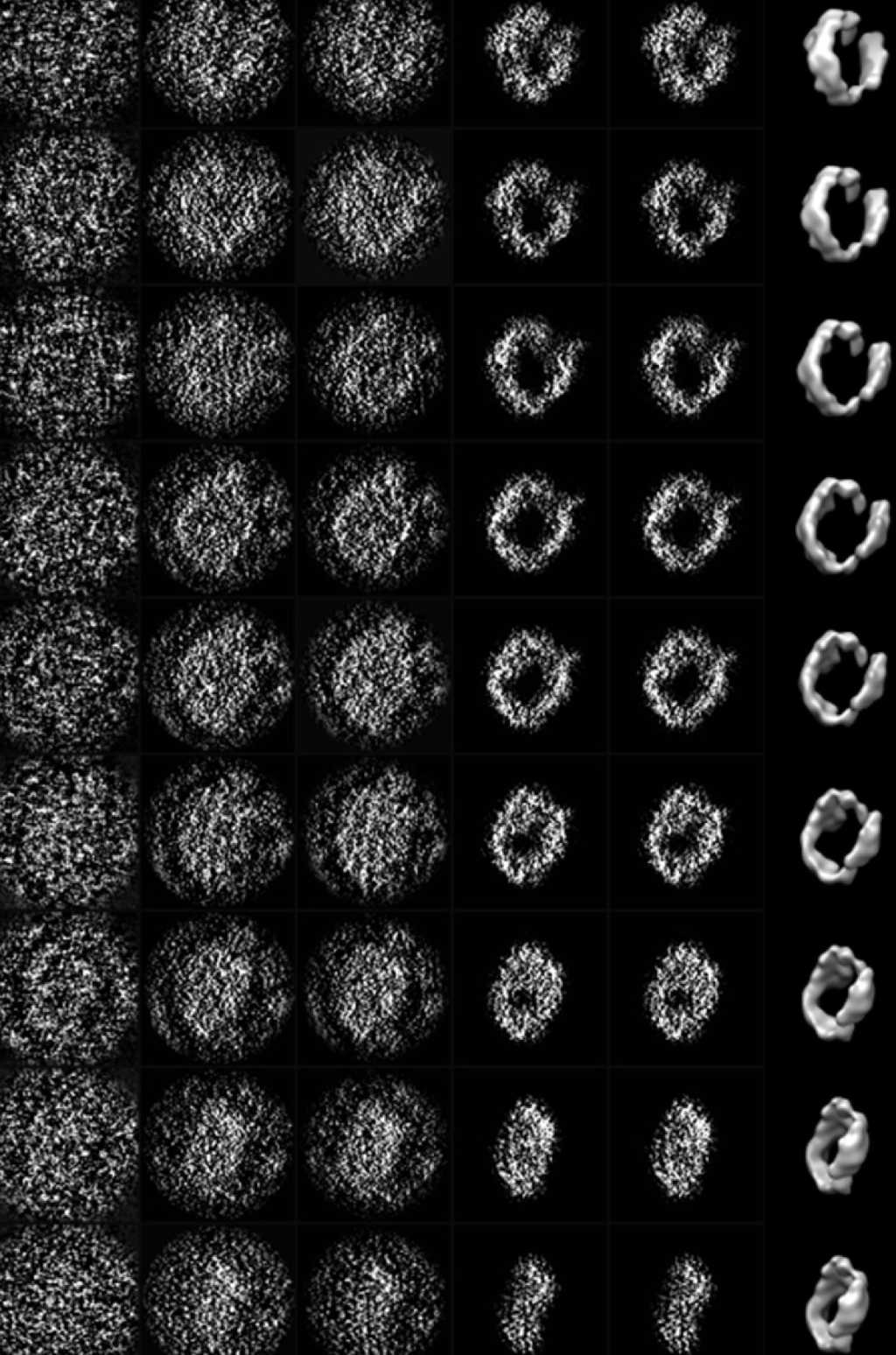
Une image de synthèse de la structure de l'apolipoprotéine A1 obtenue avec la technique Ipet (Individual-particle electron tomography)© Lawrence Berkeley National Laboratory
Ils parviennent désormais à reconstituer des images précises en 3D de la structure de certaines protéinesprotéines à partir d'une seule molécule. Jusqu'à présent, il fallait faire une moyenne des images de plusieurs milliers voire millions de molécules identiques pour faire diminuer le bruit inhérent à la méthode habituelle de cryotomographie.
Mieux comprendre les protéines avec Ipet
La nouvelle technique s'appelle Individual-particle electron tomography ou Ipet. Grâce à elle, les chercheurs ont pu voir en détail pour la première fois la structure 3D de l'apolipoprotéine A1. Il s'agit d'une protéine fabriquée par les intestins et le foiefoie, entrant dans la constitution des lipoprotéineslipoprotéines de haute densité (High density lipoprotein, HDL) responsables du transport du cholestérolcholestérol vers le foie où il pourra être éliminé. Les lipoproteines ont donc pour fonction d'éviter l'accumulation de cholestérol dans les vaisseaux sanguins et donc les risques d'athérosclérose. Ces HDL sont connues pour être qualifiées de bon cholestérol, les LDL étant appelées mauvais cholestérol.
Les images obtenues ne se contentent pas de montrer la structure de protéines de seulement 20 nanomètres. Elles permettent également d'avoir une idée de la dynamique de cette structure, sa flexibilité et les divers mouvementsmouvements qui sont autorisés et même de les reconstituer dans des animations sur ordinateurordinateur. Or, comprendre la structure 3D d'une protéine et sa dynamique est fondametal pour mieux connaître ses interactions avec les autres molécules. C'est donc une nouvelle fenêtrefenêtre sur les mystères de la vie qui vient de s'ouvrir.