au sommaire

Les ingénieurs de Stanford et du Lawrence Berkeley National Laboratory ont utilisé les rayons X ultra-brillants de l’Advanced Light Source pour étudier les réactions en cours au cœur de piles à combustible. © Michael Machala
Demandez à n'importe quel chimiste, il vous répondra que, dans un matériau constitué de fer et d'oxygène, comme l'oxyde de fer, le composant actif, d'un point de vue catalytique, est l'ion métallique. Pourtant, dans un article qui vient de paraître dans les colonnes de Nature Communications, une équipe de chercheurs américains de l'université de Stanford et du Lawrence Berkeley National Laboratory affirme le contraire. C'est en observant le comportement des électrons au cours de la catalyse grâce à un faisceau de rayons X ultra-brillants qu'ils sont parvenus à cette conclusion surprenante. « Nous pensions que l'oxygène n'était que spectateur. Il est en fait l'acteur principal de la réaction », assure William Chueh, professeur adjoint en sciences des matériaux à Stanford.
Le phénomène chimique de catalysecatalyse permet d'accélérer et de faciliter le déroulement des réactions. En pratique, il entraine donc une réduction de la consommation d'énergieénergie et une diminution de la quantité de réactifsréactifs utilisés. De ce fait, la catalyse joue un rôle capital dans la chimiechimie et plus généralement dans l'industrie moderne. Plusieurs technologies d'énergies renouvelablesénergies renouvelables dépendent de ce phénomène pour accélérer les réactions au cœur de leur potentiel. Les piles à combustible, la dissociation de l'eau ou encore la photosynthèse artificielle, par exemple. Même si le grand public n'en a souvent pas conscience, beaucoup de chercheurs travaillent donc à mieux comprendre ce phénomène.
C'est la présence, en faible quantité, d'une substance chimique appelée catalyseur qui permet à une réaction naturellement lente, de devenir exploitable par l'industrie. Le catalyseurcatalyseur, qui n'est lui-même pas consommé dans le procédé, active la réaction par le biais de composés intermédiaires instables et qui donc réagissent très rapidement.
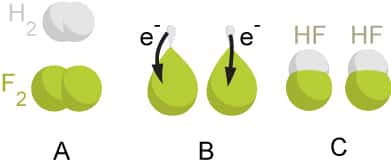
Exemple de réaction d’oxydoréduction. Celles de surface jouent un rôle important dans l’efficacité des catalyseurs à base d’oxydes métalliques. Elles ont pu être observées grâce à la spectroscopie d’absorption rayons X. Au grand étonnement de tous, ces observations ont révélé le rôle dominant des anions d’oxygène de surface. © Bensaccount
Les oxydes métalliques, catalyseurs de rêve
Les chercheurs de Stanford et du Lawrence Berkeley National Laboratory ont utilisé un faisceau de rayons X ultra-brillants de l'Advanced Light Source pour étudier des réactions activées par des oxydes métalliques. L'oxyde de fer, un matériau proche de la rouillerouille, pourrait en effet représenter le catalyseur rêvé. Car il est beaucoup plus abondant et stable que les catalyseurs classiquement utilisés aujourd'hui, basés généralement sur des métauxmétaux rares tels le platineplatine, le ruthéniumruthénium ou le rhodiumrhodium. Mais, le fonctionnement catalytique des oxydes métalliques est encore mal compris aujourd'hui. Ou du moins, jusqu'à la récente publication des chimistes américains.
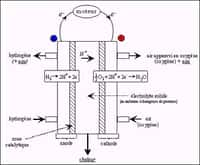
En réalité, un catalyseur est consommé puis recréé lors de la réaction. Et, les oxydes métalliques se présentent comme de bons candidats catalyseurs pour les réactions chimiquesréactions chimiques d'oxydoréduction. Celles-ci sont essentielles dans la mise en œuvre des technologies d'énergies renouvelables citées plus haut. Prenons l'exemple de la dissociation de l'eau. De l'électricité produite grâce à des panneaux solaires est injectée dans l'eau et sépare ses deux éléments constitutifs que sont l'oxygène et l'hydrogènehydrogène. Ce dernier peut ensuite être stocké pour être brûlé plus tard, afin de produire de l'électricité au moment où le soleilsoleil ne brillera plus.
Jusqu'à présent, les réactions étaient étudiées dans le vide. Dans leurs expériences, les chimistes ont, pour la première fois, observé les réactions et leurs interactions avec l'oxygène. Ils ont suivi le comportement des électrons au cours de la réaction. Et c'est ainsi qu'ils ont pu établir le rôle fondamental de l'oxygène dans la catalyse. Travailler sur les ions oxygène pourrait donc permettre aux oxydes métalliques de devenir des catalyseurs bien plus compétitifs que les catalyseurs traditionnellement utilisés aujourd'hui.