Il y a presque un siècle, la mécanique quantique donnait les clés pour comprendre la liaison chimique entre atomes, aussi bien formant des molécules que des cristaux. Les moyens de calcul modernes, avec des ordinateurs, permettent aujourd'hui de reproduire voire de prédire les propriétés et l'existence des configurations atomiques. Il y a un an, des travaux du physicien, chimiste et cristallographe russe Artem Oganov basés sur des simulations numériques élucidaient la stabilité de certains hydrocarbures. Le chercheur revient avec des collègues sur cette question, avec des hydrocarbures azotés cette fois-ci.
au sommaire
Depuis plus d'une décennie, Futura suit les travaux du physicienphysicien, chimiste et cristallographe russe Artem Oganov dont certains pensent qu'il ne serait pas surprenant un jour qu'on lui attribue un prix Nobel. Comme Futura l'avait également expliqué dans le précédent article ci-dessous, le chercheur est à l'origine d'un algorithme nommé Uspex (Universal Structure Predictor : Evolutionary Xtallography) utilisé par plus de 7 000 chercheurs dans le monde pour prédire à partir des lois de la mécanique quantique les propriétés de molécules ou de cristaux, en particulier dans des conditions de pressions et de températures exotiquesexotiques.
Toujours dans cet article, nous avions parlé de travaux publiés dans The Journal of Physical Chemistry Letters. Aujourd'hui, Artem Oganov et ses collègues Elizaveta E. Vaneeva et Sergey V. Lepeshkin viennent d'étendre ces travaux au cas des hydrocarbures azotés que l'on peut trouver aussi bien dans le milieu interstellaire, le pétrole ou encore les atmosphèresatmosphères de planètes comme Titan. C'est à nouveau The Journal of Physical Chemistry Letters qui expose ces dernières avancées. À l'avenir, Artem Oganov et ses collègues espèrent bien aller encore plus loin en étendant leur approche au point d'englober d'autres systèmes organiques et notamment les acides aminésacides aminés, les protéinesprotéines ainsi que les éléments constitutifs de l’ADN et de l'ARNARN.
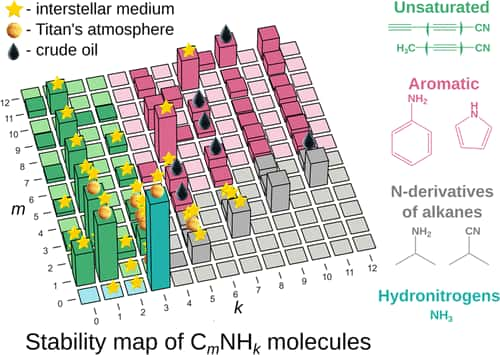
Des molécules déduites des principes de la chimie quantique
Dans un communiqué du Skolkovo Institute of Science and Technology (Skoltech), que l'on peut considérer comme l'équivalent russe du MIT (Massachusetts Institute of Technology), aux États-Unis, Artem Oganov présente ses nouvelles découvertes en ces termes : « Si vous réfléchissez à la façon dont la chimiechimie organique est souvent enseignée (NdR ex. B. Pavlov ; A. Terentiev), c'est un peu comme essayer de mémoriser les pages jaunes. Certaines molécules sont stables et donc communes, d'autres moins. Certains réagissent facilement, d'autres non. Mais pourquoi ? Il y a des règles pour répondre à ces questions, mais il ne s'agit pas d'un système soigné construit à partir de zéro - plutôt d'une collection désorganisée d'observations. Notre étude remédie à cette situation et montre comment expliquer et prédire ces choses à partir des premiers principes des systèmes composés d'atomesatomes de carbonecarbone, azoteazote et hydrogènehydrogène. Maintenant, il y a un petit tableau qui explique tout ce que nous avons vu jusqu'à présent dans l'espace ou dans le pétrole brut, et plus encore, en ce qui concerne les combinaisons de ces trois atomes. »
Elizaveta Vaneeva, encore en master à Skoltech, explique quant à elle : « Les prédictions de notre modèle concordent bien avec la liste des molécules trouvées dans le pétrole brut et dans l'espace. Mais même si le pétrole a fait l'objet d'études approfondies, en ce qui concerne le milieu interstellaire et les atmosphères planétaires, nous pourrions peut-être donner aux astrochimistes quelques indications sur ce qu'il faut rechercher, et il est beaucoup plus rapide et plus facile de découvrir de nouvelles molécules lorsque vous disposez d'une liste de candidats à portée de main. »
Et elle ajoute : « En ce qui concerne les applicationsapplications technologiques, on pourrait imaginer des chimistes organiciens essayant de synthétiser un composé industriellement utile appartenant à la classe que nous étudions. Cela pourrait être un colorant organique, par exemple un pigmentpigment bleu. Et au lieu de faire des expériences fastidieuses pour déterminer quel composé serait stable, ils pourraient utiliser notre méthode, qui repose sur des calculs fondamentaux de chimie quantique, pour prédire les candidats probables. »
Le mystère de la stabilité quantique « magique » des hydrocarbures est résolu !
Article de Laurent SaccoLaurent Sacco, publié le 22/08/2022
Il y a presque un siècle, la mécanique quantique donnait les clés pour comprendre la liaison chimiqueliaison chimique entre atomes, aussi bien formant des molécules que des cristaux. Les moyens de calcul modernes, avec des ordinateursordinateurs, permettent aujourd'hui de reproduire voire de prédire les propriétés et l'existence des configurations atomiques. Une récente application concerne l'élucidation de la stabilité de certains hydrocarbures, avec la transposition de la notion de nombres magiquesnombres magiques issue de la physiquephysique nucléaire.
On va fêter au cours de cette décennie le centenaire de la découverte des principes et des équationséquations de la mécanique quantique, essentiellement via les contributions de Heisenberg, Born, Schrödinger et Dirac. Mais on pourrait citer aussi Louis de BroglieLouis de Broglie, Niels BohrNiels Bohr, Wolfgang PauliWolfgang Pauli et bien sûr Lev Landau et Enrico FermiEnrico Fermi.
Très rapidement, grâce à la fameuse équation découverte par Schrödinger, la révolution quantique va passer de la physique à la chimie avec les travaux de plusieurs chercheurs, avec tout d'abord Walter Heitler and Fritz London qui vont poser les bases d'une théorie quantique de la liaison chimique dans la molécule d'hydrogène en 1927. Ce travail va être étendu dans les années qui vont suivre notamment par le prix Nobel de chimie Linus PaulingLinus Pauling et d'autres chercheurs - on peut citer Friedrich Hund, Robert Mulliken et John C. Slater. On verra ainsi apparaître la théorie de la liaison de valencevalence, celle des orbitales moléculairesorbitales moléculaires mais aussi des notions de chimie quantique comme l'hybridationhybridation des orbitales atomiques et aussi la mésomériemésomérie.
Pauling pourra alors expliquer l'existence et les propriétés des hydrocarbures aromatiqueshydrocarbures aromatiques, en particulier du benzènebenzène. Des explications simples à ce sujet peuvent se trouver dans le fameux cours de mécanique quantique d'un autre prix Nobel, Richard Feynman. Pour les courageux déjà bien informés, il est enrichissant de lire les ouvrages de Pauling, aussi bien son introduction à la chimie générale que son traité sur la liaison chimique (voire son traité de chimie quantique), ce dernier étant une grande référence de la chimie du XXe siècle.
Une série remarquable de cours sur la chimie quantique et son histoire. © Thomas Cauchy
Uspex et les hydrocarbures
Une nouvelle avancée intéressante dans le domaine de la chimie quantique vient d'être publiée via un article dans The Journal of Physical Chemistry Letters. Elle concerne les hydrocarbures en général et elle découle à nouveau des travaux du physicien, chimiste et cristallographe russe Artem Oganov.
Futura parle régulièrement de ses contributions en compagnie de collègues, notamment dans le domaine de la physico-chimie des matériaux à haute pression. Nous avions expliqué que sa trajectoire scientifique l'avait conduit dans plusieurs centres de recherche mondiaux de grande réputation, de l'Université d'État de Moscou jusqu'à l'Université Stony Brook en passant par l'University College London et l'ETH à Zurich. Membre un temps du mythique Institut de physique et de technologie de Moscou (MIPT pour Moscow Institute of Physics and Technology, Московский Физико-Технический институт, en russe), baptisé PhysTech (Физтех), comme on parle de l'X en France ou du MIT (Massachusetts Institute of Technology) aux États-Unis, il poursuit ses recherches en poste au Skolkovo Institute of Science and Technology (Skoltech) que l'on peut considérer comme l'équivalent russe du MIT aux États-Unis.
La percée obtenue aujourd'hui dans le domaine des hydrocarbures a été rendue possible encore une fois grâce à l'algorithme nommé Uspex (Universal Structure Predictor : Evolutionary Xtallography) que l'on doit initialement à Artem Oganov, mais qui a été développé par son groupe de recherche. En russe uspekh signifie « succès » et on peut déjà se convaincre de ses accomplissements quand on sait qu'il est utilisé par plus de 7.000 chercheurs dans le monde. Il permet de calculer ab initio à partir des lois de la mécanique quantique les propriétés de molécules ou de cristaux, en particulier dans des conditions de pressions et de températures exotiques.
Rien d'extrême dans le nouveau succès d'Uspex, comme on peut s'en convaincre en lisant le communiqué de Skoltech à ce sujet et dont nous reprenons en les traduisant quelques extraits. On peut voir aussi que la découverte publiée était déjà annoncée dans la vidéo ci-dessous datant de 2021.
Une présentation par Artem Oganov de ce que peut faire Uspex, notamment en prédisant la stabilité des molécules et leurs propriétés, des molécules d'hydrocarbures aux cristaux supraconducteurs à partir des lois de la mécanique quantique et en dressant des diagrammes de stabilité avec des énergies de liaisons. Pour obtenir une traduction en français assez fidèle, cliquez sur le rectangle blanc en bas à droite. Les sous-titres en anglais devraient alors apparaître. Cliquez ensuite sur l'écrou à droite du rectangle, puis sur « Sous-titres » et enfin sur « Traduire automatiquement ». Choisissez « Français ». © Sociedade Brasileira de Física
Des nombres « magiques » en physique nucléaire et moléculaire
Pour comprendre de quoi il en retourne il faut savoir que les hydrocarbures sont des molécules avec des atomes de carbone (C) formant une charpentecharpente sur laquelle sont collés des atomes d'hydrogène (H). Il s'agit donc d'alcanes, d'alcènesalcènes ou encore de molécules cycliques, aromatiques ou non, comme disent les chimistes dans leur jargon, tel les cyclanes (des hydrocarbures comportant un ou plusieurs cycles d'atomes de carbone unis par des liaisons simples) ou le benzène.
Ces charpentes ont pour formule générale CnHm, par exemple CH4 pour le méthane ou C6H6 pour le benzène. Des combinaisons de ces charpentes sur lesquelles on peut greffer des atomes d'oxygèneoxygène et d'azote pour former diverses fonctions chimiques vont se retrouver à la base de toute la chimie organique. Comprendre ces molécules est une clé pour prédire leurs réactions et donc pour pouvoir prédire comment les synthétiser pour diverses applications.
Toutefois, comme l'explique l'auteur principal de l'article publié, Sergey Lepeshkin : « Un manuel de chimie organique avec sa multitude désordonnée de molécules différentes fait peur. Personne ne sait pourquoi certaines molécules existent et d'autres non. Vous pouvez en apprendre beaucoup sur chaque molécule spécifique si vous dessinez sa structure chimique à l'aide de "bâtonnetsbâtonnets" pour représenter les liaisons entre les atomes, mais en réalité, de nombreux concepts liés à cela restent encore un sujet de débat et ne répondent pas à la question "Pourquoi ?". Les "bâtons" ne sont rien de plus qu'un outil abstrait pratique, alors que le critère de stabilité rigoureux pour les composés est l'énergieénergie. »
Comme l'expliquait déjà Artem Oganov dans la vidéo ci-dessus, il est possible de transposer en chimie quantique afin d'étudier la stabilité des molécules d'hydrocarbures des concepts utilisés en physique nucléaire. On a ainsi dressé depuis longtemps une sorte de carte donnant les énergies de liaisons des noyaux de divers éléments avec leurs isotopesisotopes et certains se sont trouvés être particulièrement stables au point qu'on les a appelés noyaux « magiques » avec des nombres « magiques » de protonsprotons ou de neutronsneutrons.
Ces nombres ont été découverts au cours des années 1940, mais en utilisant l'équation de Schrödingeréquation de Schrödinger pour rendre compte de ce que l'on appelle le modèle en couches des noyaux, l'analogue du modèle avec couches électroniquescouches électroniques pour les atomes, la prix Nobel de physique Maria Goeppert Mayer fut en mesure de les prédire théoriquement. C'est donc une performance similaire qu'Uspex a permis de faire en montrant qu'il existait des hydrocarbures magiques avec des nombres particuliers d'électronsélectrons pour ces molécules. Une molécule est « magique » si elle est plus stable qu'un ensemble de ses voisines dans l'espace chimique.
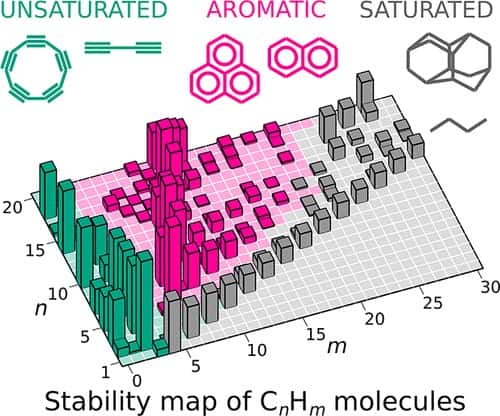
Pour cela, Uspex a été utilisé pour calculer les énergies de liaisons de molécules différentes les unes des autres par un atome de plus ou de moins, et pour dresser avec les résultats une carte des énergies de liaison similaire à ce qu'Artem Oganov avait déjà fait avec ses collègues et qui concernait des oxydes de siliciumsilicium, cartes similaires à celle des noyaux atomiques connue depuis des décennies.
Au total, ce sont de très nombreux hydrocarbures pouvant contenir jusqu'à 20 atomes de carbone et 42 atomes d'hydrogène qui ont été utilisés.
Dans le communiqué de Skoltech, Artem Oganov commente les résultats obtenus en expliquant que : « Nous avons maintenant toute la chimie des hydrocarbures sur une seule carte. Remarquablement, les crêtes de stabilité représentent les séries homologues de nos manuels scolaires, qui sont essentiellement des séries de composés avec des changements réguliers de composition, de structure et de propriétés. La carte montre clairement quelles molécules sont faciles à synthétiser et lesquelles peuvent se former spontanément et s'accumuler en grandes concentrations. Par exemple, la carte explique clairement pourquoi certains des composés existent dans les atmosphères planétaires et l'espace interstellaire, dans les flammes et dans les gisementsgisements de pétrole. Enfin, la carte peut prédire les molécules encore à trouver. D'un grand intérêt sont celles qui existent déjà, mais qui ne sont pas « magiques ». Les exemples les plus frappants incluent le cyclopropane que les chimistes considèrent comme instable en raison de liaisons tendues avec des angles non optimaux, le butadiène qui est connu pour être très actif et dont sa propension à la polymérisationpolymérisation est utilisée dans la production industrielle de caoutchouccaoutchouc, et une molécule emblématique, le cyclobutadiène, qu'il a fallu 30 bonnes années pour synthétiser. »
























