au sommaire

La médecine prédictive des maladies dégénératives
L'étude du génomegénome humain permet de connaître aujourd'hui une large proportion des gènesgènes dont l'altération est susceptible d'entraîner l'apparition de syndromessyndromes dégénératifs.
Tel est le cas de prédispositionsprédispositions aux maladies de Parkinsonmaladies de Parkinson et d'Alzheimer, dont certaines formes rares dépendent de la transmission d'un seul gène muté.
Génétique et maladies dégénératives
Le plus souvent, le terrain génétiquegénétique ne constitue qu'un facteur de susceptibilité parmi d'autres. Cependant, nombreuses sont les dégénérescences progressives de cellules nerveuses totalement liées à la transmission d'un gène altéré et dont le diagnosticdiagnostic génétique est toujours réalisable. Beaucoup de ces maladies, quoique totalement héréditaires, se manifestent plus ou moins tard dans la vie des sujets affectés. Ainsi en est-il de la maladie d'Alzheimermaladie d'Alzheimer ou d'une affection redoutable, la Chorée de HuntingtonChorée de Huntington.
Dans ce dernier exemple, les malades présentent, tandis qu'ils atteignent la quarantaine, des signes neurologiques marqués par de grands mouvements incontrôlés, puis des déficits neurologiques croissants et une démencedémence conduisant inéluctablement - souvent en une dizaine d'années - à la mort. Pour des familles comprenant déjà de tels malades, il est donc possible de pratiquer un diagnostic prénatal ou préimplantatoire.
Le diagnostic des dégénérescences
Le diagnostic prénatal (ou DPN), est en vigueur depuis des décennies. Ce dernier consiste à prélever directement des cellules de l'embryonembryon dans l'utérusutérus maternel, au début de la grossessegrossesse. En cas de dépistagedépistage d'une maladie d'une particulière gravité, la loi française du 17 janvier 1975 confère aux femmes le droit de demander une interruption de la grossesse, quel que soit le stade de son développement. Cette perspective est bien entendu traumatisante : l'avortementavortement thérapeutique peut impliquer de pénibles séquellesséquelles psychologiques, voire être totalement refusé par une femme pour des raisons religieuses.
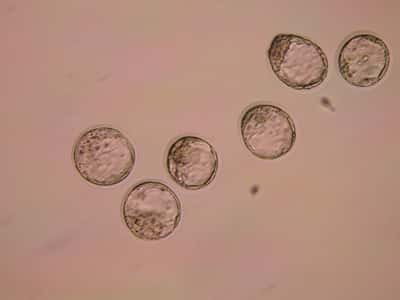
Un autre moyen bien plus récent, utilisé pour la première fois en France en 2000, (Valentin, le premier bébé français issu d'un tri d'embryons, est né le 13 novembre 2000. Opération menée par l'équipe du Pr René Frydman, de l'hôpital Antoine Béclère de Clamart [92], avec celle du généticiengénéticien Arnold Munnich, Unité 393 de l'Inserm à Paris.) consiste à passer par la fécondation in vitrofécondation in vitro. Cette fois, l'opération intervient donc avant même le début de la grossesse, en laboratoire, par des procédés artificiels. Plusieurs embryons sont conçus par fécondation de l'ovuleovule par un spermatozoïdespermatozoïde dans une éprouvetteéprouvette. Il suffit ensuite de les trier. Tout comme pour le Diagnostic prénatal, une cellule de chaque embryon constitué est d'abord prélevée, et le gène responsable de l'affection redoutée est ensuite analysé. S'il porteporte des anomaliesanomalies permettant de prévoir que l'enfant sera malade, l'embryon est écarté. Seuls les embryons sains sont, au bout du compte, placés dans l'utérus de la mère.
La question de la transmission des maladies dégénératives
Les règles prévalant à ce tri nous renvoient aux fondements mêmes de la génétique, découverts par Mendel, exposés au début de cet ouvrage. Les gènes sont distribués en deux exemplaires au moment de la fécondation : l'un vient du père, l'autre de la mère. L'un des parents peut seul transmettre une version « erronée » de tel ou tel gène, par exemple celui de la Chorée de Huntington. Cette affection est ici dite « dominante », ce qui signifie qu'elle frappe toute personne dès lors qu'elle porte une seule copie du gène anormal. Ce type de transmission diffère donc de celles des maladies génétiquesmaladies génétiques récessives, telle la mucoviscidosemucoviscidose, où seuls les enfants qui ont hérité d'un gène muté de chacun des parents sont affectés.
Dans l'hypothèse d'une transmission dominante, certaines situations se révèlent redoutables et traumatisantes : imaginons le cas d'une personne informée du fait qu'elle risque de transmettre le gène muté. L'un de ses parents, un frère ou bien un cousin, a déjà développé une Chorée de Huntington. Attendant un bébé, la personne concernée demande de recourir à un diagnostic prénatal, mais ne désire pas elle-même connaître son état. Si le test pratiqué sur des embryons se révèle positif, cela démontre sans ambiguïté qu'elle a bien transmis le gène muté, et qu'elle est par conséquent elle-même affectée. Un jeune homme ou une jeune femme en pleine santé, désirant avoir des enfants, se voit signifier qu'il ou elle porte au sein de ses cellules une malédiction génétique qui le ou la condamne inéluctablement ! Nous percevons la difficulté devant laquelle se trouvent les biologistes dans de telles situations : le parent « à risque » refuse toute information en ce qui le concerne, mais ne souhaite nullement mettre au monde un enfant programmé pour développer la Chorée de Huntington. Aucune des solutions proposées afin de surmonter un tel casse-tête n'est pleinement satisfaisante.

Puce à ADN (Plateforme de Séquençage de l'Institut Cochin).
La question de la qualité de vie
Une seconde difficulté éthique de ce type de diagnostic est liée à la conception que l'on peut se faire d'une vie destinée à se dégrader quarante ans après son avènement. En d'autres termes, doit-on empêcher la naissance d'un enfant si l'on apprend qu'il risque de tomber gravement malade plusieurs décennies plus tard ? Il n'existe aucune réponse simple à ce type d'interrogations, et la difficulté ne peut être surmontée que dans le dialogue avec les parents, au terme de longues discussions entre associations de malades, médecins, généticiens, philosophes... Par ailleurs, on ne peut s'empêcher d'observer, sans qu'il soit possible de condamner le principe même d'une telle action, que l'élimination systématique des embryons atteints ne reflète pas non plus une franche confiance dans le pouvoir de la médecine. En effet, le gène dont la mutation entraîne la Chorée de Huntington est aujourd'hui connu, de même que certains mécanismes de la dégénérescence nerveuse inhérente à la maladie. Éviter toute naissance de telles personnes à risque dénote un profond scepticisme quant aux chances de développer, dans les quarante années à venir, une thérapeutique efficace...
Le diagnostic présymptomatique
En dehors du diagnostic prénatal ou bien préimplantatoire des mutations géniquesgéniques impliquées dans ces maladies neurodégénérativesmaladies neurodégénératives, demeure la question de leur diagnostic présymptomatique - c'est-à-dire avant toute manifestation pathologiquepathologique - chez un sujet en bonne santé, mais dont les antécédents familiaux démontrent qu'il peut avoir hérité du gène anormal, et donc qu'il risque plus tard de développer la maladie. D'une part, il n'est jamais facile d'annoncer à une personne, en pleine forme, qu'elle sera inéluctablement affectée par une affection neurologique pénible, dégradante et mortelle - à moins d'un spectaculaire progrès de la médecine. Cela dit, si la même personne à risque requiert elle-même un diagnostic, et qu'elle réitère cette demande après avoir été informée de ses conséquences, il paraît difficile de lui refuser. En effet, l'angoisse engendrée par le doute concernant son état peut s'avérer tout aussi insupportable que celle qui découlera, le cas échéant, de la confirmation de son destin malheureux. En fait, près de la moitié des personnes venant consulter pour de tels diagnostics renoncent à s'y soumettre après avoir reçu une information suffisante. Parmi les autres, si le test est positif, se développent alors fréquemment des difficultés psychologiques exigeant un fort soutien.
Ces diagnostics génétiques « présymptomatiques » de maladies dégénératives à révélation tardive impliquent une dernière incertitude : l'attitude des employeurs et des assurances privées à l'égard des personnes à risque. Il s'agit-là d'un débat qui fait l'objet, depuis plus de dix ans, d'âpres discussions dans le monde entier, mais aucun consensus n'a encore pu être obtenu. Le législateur français a totalement interdit l'utilisation de tels tests génétiques dans le calcul des primes d'assurance ainsi que dans la sélection à l'embauche.
En revanche, les Anglais ont jusqu'à présent refusé à légiférer, notamment sous la pression des grandes sociétés d'assurance privée. Or, le système assurantiel, comme l'ensemble des services, est progressivement mis en concurrence ouverte dans l'Union européenne, avant de l'être un jour à l'échelle mondiale. Il apparaît donc clair que les conséquences de la prédiction génétique des maladies neurodégénératives, surtout celles qui se révèlent tardives, seront difficiles à gérer.