au sommaire
L'hémoglobine (Hb) est la protéine des globules rouges qui sert au transport de l'oxygène dans les tissus et qui donne la couleurcouleur rouge du sang. Elle est synthétisée dans la moelle osseuse par les érythroblastes (les précurseurs des globules rouges) à raison de 6 à 8 g par jour.
Il existe trois types d'hémoglobine : HbA, HbA2 et HbF. Cette dernière se retrouve chez l’embryon et disparait totalement du sang avant l'âge de 1 an.
Structure et fonction de l’hémoglobine
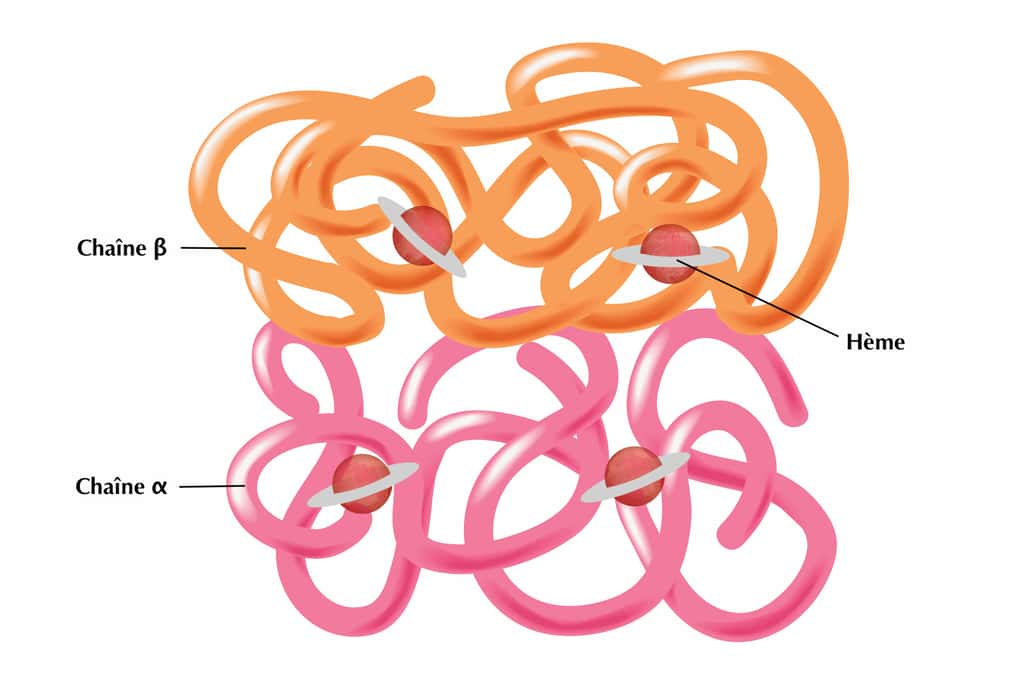
La protéine d'hémoglobine est constituée de quatre unités de globine (deux unités d'alpha-globine et deux sous-unités de bêtabêta-globine) enroulées sur elles-mêmes, avec au centre l'hème où se loge un ionion ferfer (fer ferreux Fe2+). Chaque moléculemolécule d'hémoglobine contient ainsi quatre atomesatomes de fer. Lorsque l'oxygène arrive dans le sang, les molécules d'oxygènes se fixent au fer de l'hème. Une fois liée à l'oxygène, l’hémoglobine devient l'oxyhémoglobine. À l'inverse, elle forme la carbhémoglobine lorsqu'elle se lie avec le dioxyde de carbonedioxyde de carbone. Le dioxyde de carbone est ensuite transporté par le sang vers les poumonspoumons où il est expiré.
L'affinité de l'hémoglobine pour l'oxygène dépend de plusieurs facteurs, dont le principal est la pressionpression partielle en oxygène (plus la pression est élevée et plus l'affinité de l'Hb pour l'oxygène baisse). Une baisse du pH du sang, l'augmentation de la température ou du 2,3 DiphosphoGlycérate (DPG) ont pour effet d'abaisser l'affinité de l'hémoglobine pour l'oxygène.
La teneur normale en hémoglobine est de 13 à 18 g pour 100 ml de sang chez l'homme et de 12 à 16 g pour 100 ml chez la femme. Ce taux est variable selon les individus et les conditions de vie. Les personnes vivant en altitude ont généralement des taux d'hémoglobine plus élevés, alors que l'hémoglobine tend à être plus basse chez les hommes âgés, les enfants et pendant la grossessegrossesse.
Pathologies et anomalies de l’hémoglobine
Plusieurs maladies génétiques se caractérisent par une anomalieanomalie de la synthèse d'hémoglobine avec, pour conséquence, une production insuffisante ou un défaut dans la structure de la protéine.
- thalassémiesthalassémies (α-thalassémie ou β-thalassémie selon la chaîne affectée) : la structure est normale mais la production diminuée ;
- drépanocytosedrépanocytose : mutation du gènegène codant pour la β-globine, qui aboutit à un type anormal d'hémoglobine appelé hémoglobine S ;
- autres hémoglobinopathies : une chaîne de globine est structurellement anormale.
L'hémoglobine peut aussi être affectée par un changement de structure diminuant sa capacité à transporter l'oxygène, comme lors d'une intoxication.
- méthémoglobine (transformation du fer ferreux de l'hème en fer ferrique Fe3+) ;
- sulfhémoglobine (fixation d'un ion sulfuresulfure sur l'hème) ;
- carboxyhémoglobinecarboxyhémoglobine (fixation d'atome de monoxyde de carbonemonoxyde de carbone CO sur l'hème).
Les maladies de l'hémoglobine se traduisent le plus souvent par une anémieanémie, une pâleur, des difficultés respiratoires, ou encore des crises de douleursdouleurs.