au sommaire
Mais de tels composants, qui comportent 10% de métauxmétaux précieux en poids, s'avèrent très onéreux.
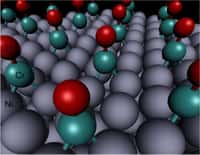
C'est pourquoi Maria Flytzani-Stephanopoulos et ses collègues, de l'Université de Tufts (Massachusetts), ont tenté de réussir la même réaction avec le moins d'or ou de platineplatine possible ; ils ont ainsi pu démontrer que ce n'était pas le métal lui-même qui jouait le rôle de catalyseurcatalyseur mais la structure non métallique constituée du support (CeO) et du métal (Au ou Pt).
Une découverte qui permet dès lors d'envisager une réduction significative des quantités de métaux précieux utilisés. Ces résultats, loin d'être anecdotiques, laissent entrevoir d'importantes retombées économiques. La réaction de gazgaz à l'eau constitue en effet la base du fonctionnement des piles à combustiblespiles à combustibles.
Et avec l'annonce par le Président Bush d'investir 1,2 milliards de dollars dans la recherche sur ce type d'énergieénergie, le prix du platine n'a jamais été aussi haut depuis 23 ans.