au sommaire
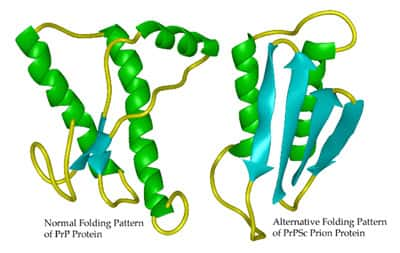
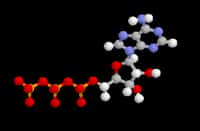
Changement de conformation de la protéine Prp (prion). La forme de gauche est la forme non pathogène, la forme de droite est la forme pathogène. (crédit : Whitehead Institute The Massachusetts Institute of Technology)
La «maladie de la vache follemaladie de la vache folle» et sa forme humaine, la maladie du nouveau variant de Creutzfeldt-JakobCreutzfeldt-Jakob, sont transmises par des agents «non conventionnels» encore énigmatiques, nommés prions. Selon les connaissances actuelles, les prions seraient constitués essentiellement de protéines. Une protéine prion peut adopter au moins deux structures spatiales différentes: une normale soluble que l'on trouve sous cette forme tout naturellement dans beaucoup de tissus, et une forme pathologiquepathologique, agrégée en fibres amyloïdes. C'est cette dernière que l'on trouve dans les lésions cérébrales de patients atteints de la maladie. Selon Stanley G. Prusiner (Prix Nobel de médecine 1997), qui a identifié pour la première fois le prion, la présence de la forme pathologique force la forme normale à se transformer en forme pathologique, celle-ci devenant alors responsable non seulement des dégâts causés au système nerveux central, mais aussi de l'infectiosité de l'agent prion. Cette hypothèse n'est toujours pas démontrée, et la question de savoir comment une structure protéique stable peut se transformer en une autre structure stable, contenant des fibrillesfibrilles amyloïdes, reste encore entourée d'un grand mystère.
L'approche utilisée jusqu'ici pour reproduire la forme pathologique in vitroin vitro, consistait à induire ce changement de structure de la protéine prion par la chaleurchaleur ou par un agent chimique. L'hypothèse sous-jacente étant qu'en dépliant partiellement la protéine, elle pourrait se replier sous la forme pathologique. Malgré d'intenses efforts, ces travaux n'ont jamais été couronnés de succès. Une explication possible à cet échec est que le changement de structure in vivoin vivo requiert des conditions très particulières, difficiles à reproduire. A ce titre, il est intéressant de noter que les progrès récents de la biophysique, concernant le repliement de protéines, ont révélé l'existence de «paysages énergétiques» de ce processus. Le repliement des protéines passe par une multitude de chemins alternatifs, qui ne sont accessibles que dans certaines conditions physico-chimiques.
Les chercheurs montpelliérains spécialisés dans la biologie structurale sous haute pressionpression, ont alors tenté une autre voie, celle de l'utilisation des hautes pressions, afin de perturber le paysage énergétique de la protéine prion. Ils avaient auparavant montré, dans leurs travaux avec des protéines modèles, que les hautes pressions (jusqu'à 7000 barbar) pouvaient affecter d'une manière spécifique les structures de protéines, en privilégiant une altération de l'hydratationhydratation de la moléculemolécule. Cette approche a été combinée avec une méthode originale d'analyse spectrale d'absorbance UVUV développée au laboratoire.
Leurs travaux montrent l'existence d'une multitude de structures intermédiaires possibles entre la protéine prion native (normale) et sa forme dépliée. Selon les conditions de température, de pH et de pression, on peut privilégier la formation de l'une ou l'autre de ces structures. De plus, un choix judicieux de conditions expérimentales permet soit de les stabiliser, soit d'inverser leur formation. Deux de ces structures se révèlent particulièrement intéressantes: une structure pré-amyloïde, et une structure agrégée en fibres amyloïdes, similaire ou identique à la structure pathologique que l'on trouve dans le cerveau de malades. Des expériences sont actuellement en cours pour déterminer si ces deux structures sont infectieuses.
Ces résultats ouvrent tout un champ d'investigations de transformation structurale des protéines prions. De nouvelles combinaisons «température pression» sont actuellement testées pour obtenir d'autres types d'intermédiaires structuraux. Si l'une de ces formes intermédiaires se révélait infectieuse, les chercheurs obtiendraient donc un modèle de recherche in vitro, ouvrant ainsi des perspectives thérapeutiques. Cette démarche est confortée par des travaux récents des groupes d'Akasaka (Japon) et de Prusiner (Etats-Unis), utilisant la Résonance Magnétique NucléaireRésonance Magnétique Nucléaire sous pression.