au sommaire
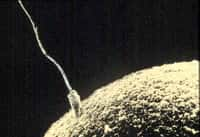
Durant la reproduction, les spermatozoïdes se chargent d'apporter l'ADN mâle aux organes sexuels féminins, relevant au passage un véritable défi. En effet, quoi qu'il arrive, le patrimoine génétique livré doit conserver son intégritéintégrité afin d'autoriser la fécondation. Pour y arriver, le génome change progressivement de configuration spatiale lors de la spermatogenèse, c'est-à-dire durant la formation des gamètes, afin d'être véhiculé sous une forme compacte et résistante. Toute défaillance de compactage peut entraîner une infertilité.
Les moléculesmolécules qui participent au compactage de l'ADN (histoneshistones, protéinesprotéines de transition, protamines) sont connues depuis longtemps. Cependant, les déterminants moléculaires à l'origine de ces changements rapides de configuration restent mystérieux. Ou plutôt, pour être exact, restaient mystérieux.
À l'Inserm, l'équipe Épigénétique et signalisation cellulaire de Saadi Khochbin, directeur de recherche au CNRS, vient de décrire pour la première fois comment, dans les cellules germinalescellules germinales mâles, un élément organisateur dirige l'empaquetage compact, précis et spécifique du génome. Il s'agit d'une histone particulière nommée TH2B, l'une des premières histones identifiées dès 1975.
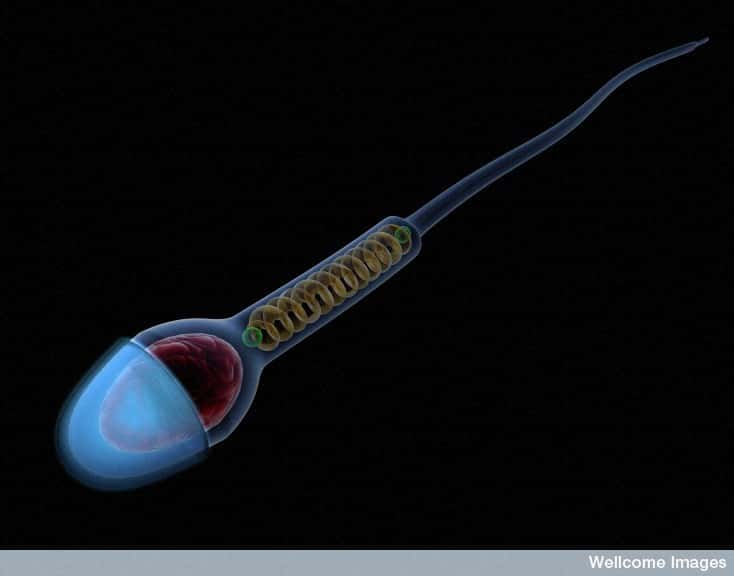
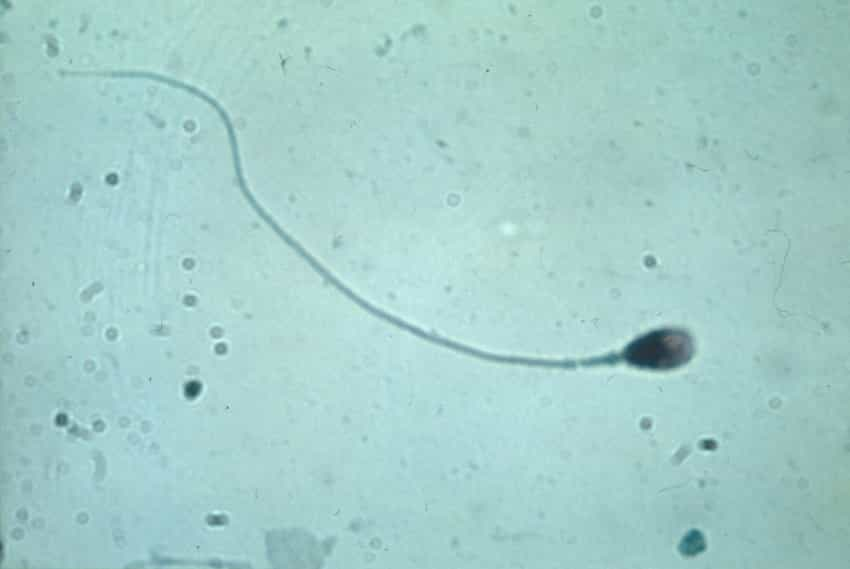
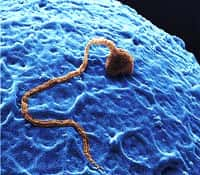
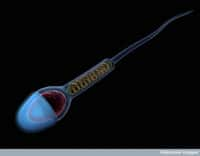
Le spermatozoïde possède une tête, où se trouvent le noyau et l'ADN mâle, et un flagelle qui assure la mobilité. © Anna Tanczos, Wellcome Images, Flickr, cc by nc nd 2.0
L'empaquetage de l’ADN pour optimiser la PMA
Cette petite protéine se fixe à l'ADN au cours de la spermatogenèse, et lui donne donc la configuration requise pour son compactage final, en vue de son voyage vers l'ovocyteovocyte. Étonnamment, les chercheurs ont également montré que cette histone est aussi présente dans le gamète femelle et contribue, après fécondation, à rempaqueter le génome mâle à la suite de son entrée dans la cellule germinale femelle.
« Nous avons donc découvert un élément important dans la transmission de l'information génétique paternelle, qui participe non seulement à son conditionnement pour une expédition par l'organe reproducteur mâle, mais également à sa réceptionréception par la cellule femelle », explique Saadi Khochbin, principal auteur de l'étude publiée dans Genes and Development.
Cette recherche a nécessité la mise en place de plusieurs modèles de souris, ainsi que le développement d'approches impliquant de récentes technologies sophistiquées. Leurs buts : explorer le génome dans sa globalité (techniques génomiquesgénomiques, transcriptomiques), et comprendre de nouveaux mécanismes à l'échelle moléculaire (approches protéomiques et modélisationsmodélisations structurales). Sur un plan fondamental, ces travaux améliorent les connaissances de la transmission du génome mâle lors de la reproduction. Par ailleurs, ils ont également des implications dans la compréhension de l'infertilitéinfertilité et dans l'optimisation de la procréation médicalement assistéeprocréation médicalement assistée (PMA).