Le variant indien, qui circule depuis quelques semaines en Inde, porte plusieurs mutations dans sa protéine S. Comment affectent-elles ses interactions avec le récepteur cellulaire ACE2 ou les anticorps neutralisants ? Une étude prépubliée offre les premiers éléments de réponse.
au sommaire
L'Inde est le deuxième pays le plus touché par la Covid-19 dans le monde, devant le Brésil et derrière les États-Unis, avec 17,3 millions de cas confirmés. Depuis quelques semaines, l'épidémie est devenue hors de contrôle. Le nombre de cas augmente exponentiellement, tout comme le nombre de morts. Pour la seule journée du 25 avril 2021, 350.000 nouvelles infections ont été confirmées. Plusieurs pays, dont la France, le Royaume-Uni et les États-Unis, ont promis d'apporter leur soutien au pays. À New Delhi, la capitale, le confinement est prolongé d'une semaine.
Cette recrudescence sans précédent de l'épidémie est-elle liée à la propagation du variant indienvariant indien du SARS-CoV-2 ? Aucun lien de cause à effet n'a été mis en évidence à l'heure actuelle. Les mutations qu'il porteporte, et qui sont déjà connues, lui confèrent un avantage évolutif certain favorisant sa propagation. Trois d'entre elles, L452R, E484Q et P681R font l'objet d'une petite étude publiée sur le serveur bioRxiv par les scientifiques de l'Institut national de virologie de Pune. Grâce à la cristallographiecristallographie, ils ont pu analyser les interactions entre la protéine S du variant indien et le récepteur ACE2.
Un lien avec ACE2 renforcé...
Les mutations L452R et E484Q sont situées dans le receptor binding domain (RBD) de la protéine S, la région qui interagit physiquement avec ACE2. Chez les variants ne possédant pas la mutation L452R, la leucine (L) forme avec deux autres acides aminésacides aminés voisins, une poche hydrophobehydrophobe à la surface du RBD. Chez le variant indien, la leucine est remplacée par une argininearginine (R) qui n'est pas hydrophobe. La poche hydrophobe est donc rompue. Selon le calcul des scientifiques, la formation du complexe ACE-mutant indien nécessite moins d'énergieénergie (-94543.180 kcal/mol) en comparaison à la souche non-mutée (-93732.305 kcal/mol).
L'acide glutamiqueacide glutamique en position 484 de la protéine S (E484) forme une liaison électrostatiqueélectrostatique avec un résidu du récepteur ACE2. Remplacée par une glutamineglutamine dans le variant indien (E484Q), cette liaison n'existe plus. Les scientifiques pensent que le complexe RBD-ACE2 dans le cas du variant indien est plus stable, notamment à cause de la disparition de la poche hydrophobe.
Une autre mutation, P681R, n'est pas située dans le RBD, mais dans la région d'action de la furine, une protéaseprotéase qui coupe au niveau d'un enchaînement d'acides aminés basiques. Chez le variant indien, la prolineproline (P) est remplacée par une arginine (R), qui est précisément un des acides aminés reconnus par la furine. L'action de cette dernière est indispensable pour séparer les deux sous-unitéssous-unités de la protéine S et amorcer la fusionfusion du virusvirus avec la membrane de la cellule-hôte. La mutation P681R pourrait donc accroître le taux de fusion membranaire et d'internalisation du virus, et automatiquement, sa transmissibilité selon les scientifiques.
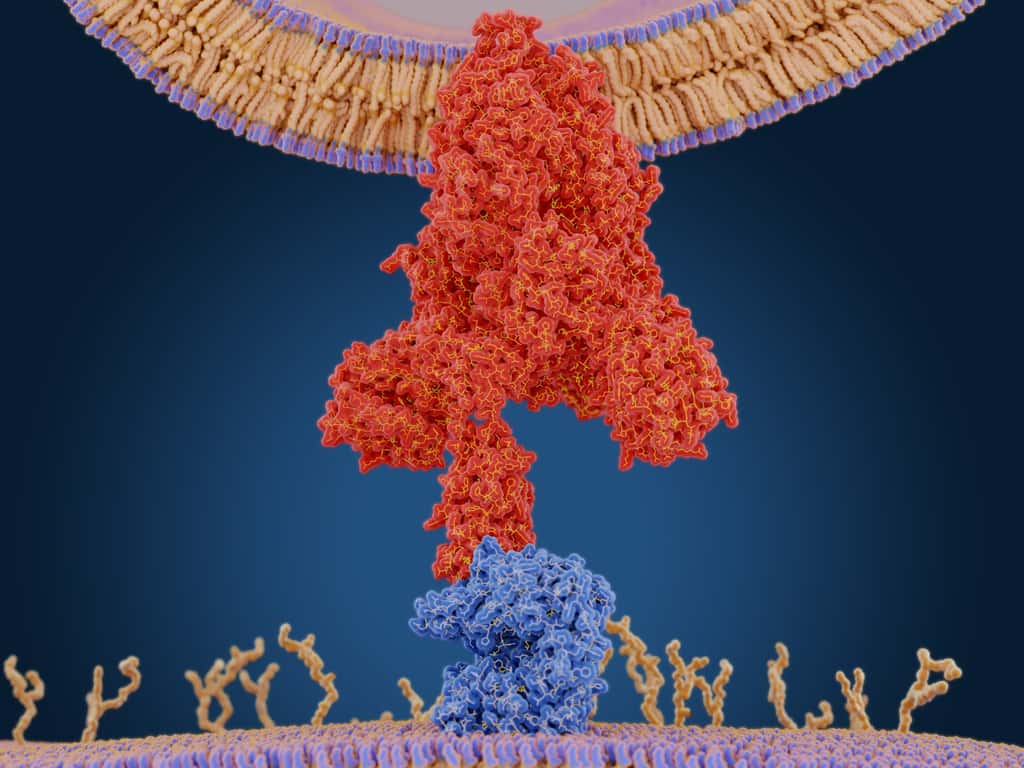
...et avec les anticorps affaiblis
Les scientifiques indiens ont aussi observé les changements d'interaction entre le mutant indien et un anticorpsanticorps monoclonalmonoclonal neutralisant (REGN10933). Comme cela avait été observé pour d'autres variants, la mutation E484Q empêche la formation d'une liaison hydrogèneliaison hydrogène entre la protéine S et la chaine lourde de l'anticorps. La mutation L452R prive aussi l'anticorps d'un point d'accroche au virus, une interaction hydrophobe cette fois-ci. Combinées, ces deux mutations diminueraient l'efficacité des anticorps neutralisants.
Actuellement, le variant indien B.1617 n'est pas considéré comme un variant d'inquiétude (VOC), comme les variants anglais, brésilien ou sud-africain, mais comme un variant d'intérêt (VOI). Un variant d'intérêt présente des mutations qui modifient sa fixation au récepteur, réduisent l'action des anticorps neutralisants et qui peuvent compliquer le diagnosticdiagnostic. Si les scientifiques prouvent qu'il est bel et bien plus contagieuxcontagieux et plus létallétal, alors il sera probablement considéré comme un variant d'inquiétude.