La microscopie à ADN permet d’observer à la fois la disposition des cellules et leur contenu génétique, grâce à une approche ingénieuse combinant biochimie et reconstitution algorithmique. Une approche entièrement nouvelle qui permettra par exemple de localiser des cellules mutantes dans des tissus.
au sommaire
Des progrès considérables ont été accomplis dans l'observation des cellules vivantes depuis l'invention du microscope optique il y a plus de quatre siècles. Mais, si ces appareils sont très performants pour cartographier l'organisation spatiale des cellules, ils sont incapables d'identifier le matériel génétiquematériel génétique de ces dernières. Il faut alors recourir à des techniques additionnelles de séquençage ADN qui, elles, ne prennent pas en compte la disposition de cellules.
La chimie pour remplacer l’optique
C'est une nouvelle approche combinant ces deux objectifs qu'ont mis au point des chercheurs du Broad Institute de Cambridge, détaillée dans un article publié le 20 juin dans la revue Cell. Baptisée microscopie à ADN, leur technique n'utilise ni instrument optique ni séquençage physiquephysique, mais repose sur la reconstruction d’image à partir de la proximité relative des cellules entre elles grâce à leurs échanges biochimiques.
Les chercheurs ont d'abord créé des version ADN de l'ARN des cellules pour pouvoir les suivre. Ils ont ensuite marqué chaque moléculemolécule d'ADN avec une « étiquette » (des courtes séquences d'ADN), puis ont procédé à une amplification pour produire une grosse quantité de ces molécules marquées. Si deux molécules sont à proximité l'une de l'autre, elles vont alors se lier et engendrer une étiquette unique qui signe leur rencontre. Il est ainsi possible de déterminer la position relative de chaque cellule. Ces étiquettes uniques sont ensuite comptabilisées grâce à un séquençage ADN et l'image est reconstruite via un algorithme informatique. « Imaginez les molécules d'ADN originales comme des tours radio qui s'envoient des messages sous forme de molécules d'ADN, illustre Joshua Weinstein, principal auteur de l'étude. Quand une tour communique avec une autre tour voisine, le signal de transmission entre elles est utilisé pour cartographier leur emplacement ».
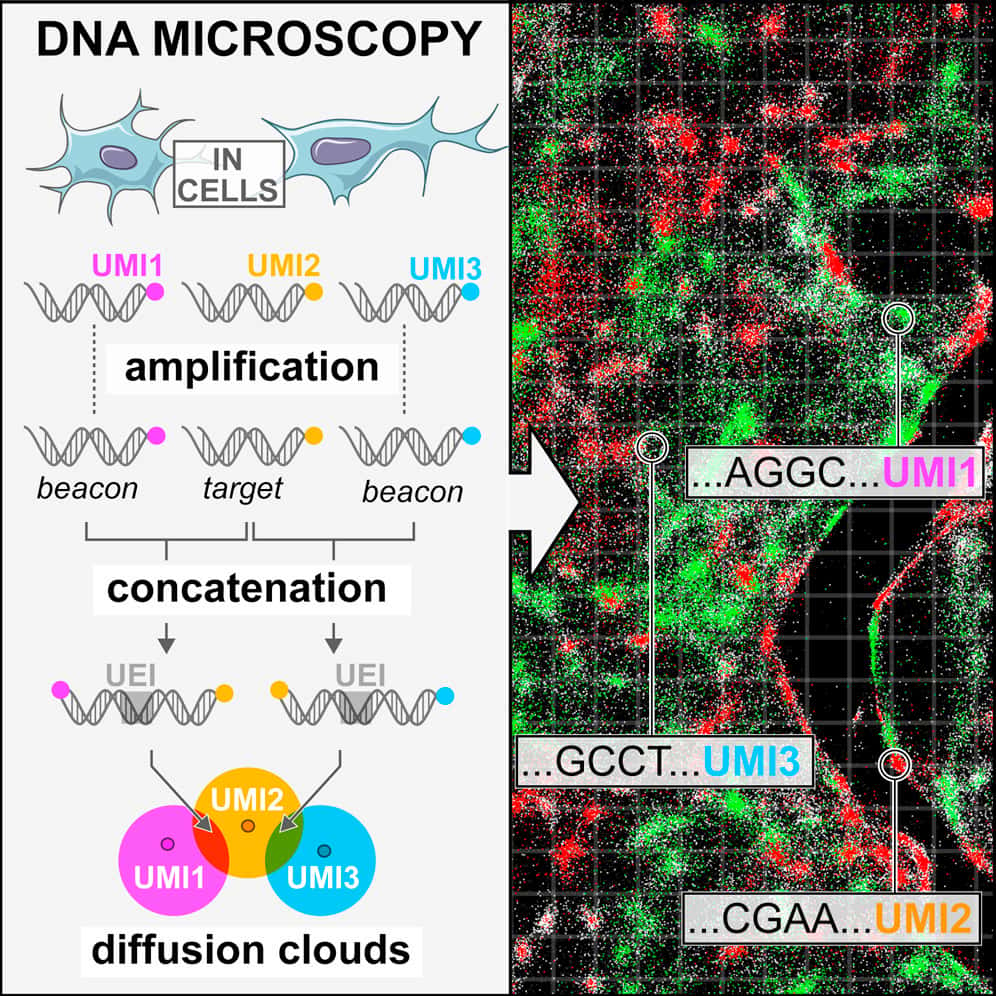
Localiser les cellules mutantes grâce à leur ADN
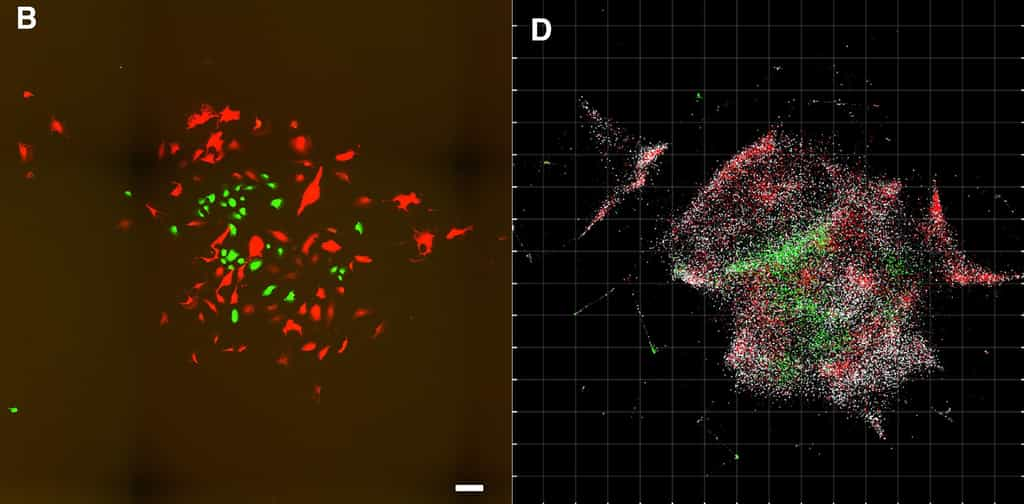
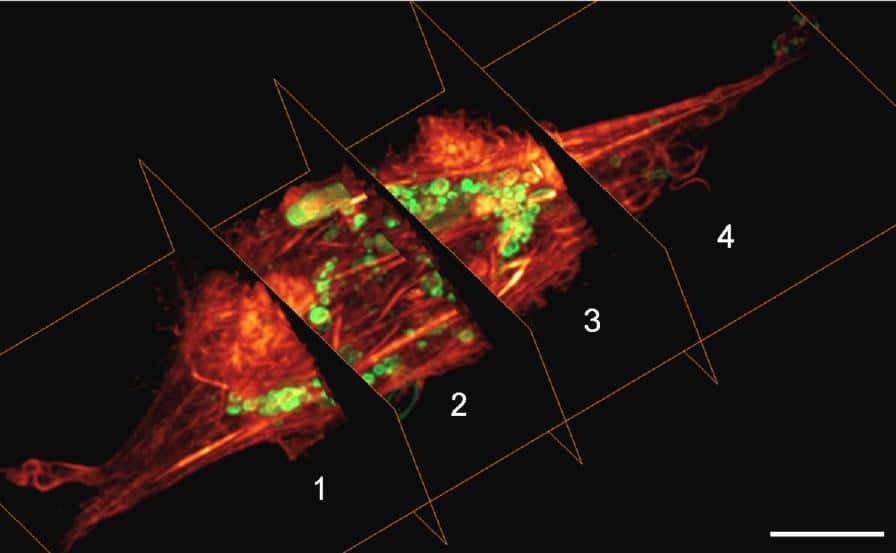
Pour tester leur système, les chercheurs ont utilisé des cellules portant des gènes codant pour des protéines vertes ou rouges. L'image obtenue est moins nette et moins lumineuse que celle d'un microscope optiquemicroscope optique, mais on distingue à la fois les gènes verts et rouges ainsi que leur répartition spatiale.
« L'objectif n'est pas de remplacer la microscopie optique, assure Joshua Weinstein au magazine Science. Mais la microscopie à ADN peut faire certaines choses que la microscopie optique ne peut pas faire, comme distinguer les cellules mutantes (cellules tumorales avec des mutations spécifiques ou cellules immunitaires) ». Une piste prometteuse pour améliorer les traitements contre le cancercancer, espère le chercheur. La microscopie ADN pourrait également aider à l'étude des cellules du système nerveux, qui produisent de l'ARN unique leur permettant de fabriquer des protéines spécialisées.
Le concept en est encore au stade préliminaire : il faudra le tester sur un vrai échantillon issu d'une biopsie pour vérifier sa validité. De plus, la technique bute encore sur la représentation des espaces vides (où aucun marqueur n'est présent). Mais elle offre l'avantage de ne pas être limitée par la pénétration des ondes dans les échantillons, et contrairement aux microscopes traditionnels, il est possible de traiter de grandes quantités de tissus parallèlement.
On peut filmer les cellules en 3D grâce à un nouveau microscope
Article de Claire Peltier publié le 08/03/2011
La microscopie ne cesse d'évoluer. Aujourd'hui, il est désormais possible d'observer l'intérieur des cellules en temps réel et... en 3D ! On n'attend plus que le son...
Observer les mouvementsmouvements internes des cellules serait un gros avantage pour les biologistes qui pourraient suivre en temps réel les processus cellulaires. Mais les microscopes semblaient avoir atteint leurs limites. Les microscopes électroniques, qui peuvent atteindre une résolutionrésolution de quelques nanomètresnanomètres, ne s'utilisent que sur des tissus fixés. Quant aux microscopes optiques, qui permettent de garder les échantillons vivants, ils sont bridés à une résolution de 200 nanomètres, le seuil de diffractiondiffraction de la lumièrelumière.
Depuis quelques années, des solutions sont nées des cerveaux des scientifiques. Les techniques de PALMPALM ont réussi à défier les limites de diffraction de la lumière et parviennent à atteindre une résolution flirtant avec les 10 à 20 nanomètres ! Malheureusement, le système d'acquisition des images, point par point, demande beaucoup de temps et ne permet pas d'observer une dynamique. De plus, comme la majorité des microscopes optiques, la lumière émise par le microscope sur l'échantillon est nocive pour les cellules vivantes et affaiblit la fluorescence des marqueurs biologiques, ce qui nuit à la qualité et à la duréedurée des observations.
C'est dans ce contexte problématique qu'est née une nouvelle forme de microscopie, aux multiples avantages, créée par les scientifiques du Howard Hughes Medical Institute à Chevy Chase aux États-Unis. Elle permet d'observer l'intérieur des cellules en mouvement, en trois dimensions, et ce sans endommager les tissus ! Explications.
Améliorer la netteté
La première stratégie est d'illuminer l'objet à observer non pas par le dessus, mais par le côté. Ceci est réalisable à l'aide de deux objectifs (d'illumination et de détection), situés perpendiculairement l'un par rapport à l'autre. La lumière en provenance de l'objectif d'illumination n'arrive pas directement dans l'objectif de détection, qui ne reçoit alors que la lumière déviée. Ainsi, seul le plan focal de l'échantillon que l'on souhaite observer est illuminé. Le reste de l'objet ne souffre donc pas inutilement de la lumière, et de plus on gagne en netteté.
Mais si cette technique est déjà utilisée pour observer de gros échantillons, le faisceau lumineux est en général trop large pour s'adapter aux quelques micronsmicrons d'épaisseur d'une cellule. Pour affiner le diamètre du rayon lumineux, les scientifiques ont pensé à utiliser un faisceau de Bessel (utilisé dans la détection des codes barres) qui ne diffracte théoriquement pas, mais qui comporte aussi son lot de problèmes.
Il existe notamment un cercle plus large autour du rayon principal, qui diminue la netteté de l'image. Pour l'éliminer, les physiciensphysiciens ont modifié deux paramètres. Tout d'abord, au lieu d'illuminer continuellement l'échantillon, ils ont fait en sorte d'allumer et d'éteindre le faisceau sans cesse, de façon très rapide. De plus, ils ont utilisé ce que l'on appelle la microscopie biphotonique, où les photonsphotons émis possèdent la moitié de l'énergieénergie nécessaire à l'excitation des molécules. Ainsi, seule la zone où le rayon lumineux est le plus focalisé est excitée, ce qui préserve les autres plans focaux.
Accélérer l’acquisition des images
Les problèmes éliminés, il n'y avait plus qu'à balayer l'échantillon pour réaliser l'acquisition d'un maximum d'images le plus rapidement possible. Ainsi, 200 images sont obtenues par seconde, sur autant de plans focaux, suffisamment pour obtenir une reconstruction tridimensionnelle de l'échantillon à raison d'une toutes les 1 à 10 secondes.
Comme ils l'avaient espéré, les chercheurs peuvent obtenir des centaines d'images 3D sans endommager la cellule, permettant d'observer sans problème de longs processus cellulaires comme la mitosemitose (pour voir les vidéos, visitez le site du HHMI). « Il n'existe pas d'autre technique qui permette une imagerie aussi longue, avec des détails spatiotemporels aussi nets », explique Eric Betzig, l'un des auteurs de l'article paru dans Nature Methods. Pour aller encore plus loin, ils vont maintenant tenter d'adapter la technique aux microscopes de super-résolutionmicroscopes de super-résolution...
Ce qu’il faut
retenir
- Une nouvelle technique de microscopie à ADN permet d’observer la disposition spatiale des cellules et de leurs gènes.
- Elle combine une approche biochimique et algorithmique pour reconstruire l’image.
- Elle pourrait être utilisée pour localiser des cellules présentant des mutations ou étudier le système nerveux central.