Les bactéries résistantes aux antibiotiques donnent du fil à retordre aux médecins qui les affrontent et elles constituent un réel problème de santé publique. Enterococcus faecalis, responsable d’infections nosocomiales, possède un système de défense ultra rapide et efficace qui pourrait aussi bien être son talon d'Achille.
au sommaire
Les bactéries pathogènes possèdent toutes sortes d'armes incroyables pour résister aux traitements antibiotiques que nous leur infligeons. Elles fonctionnent si bien que nous sommes en train de perdre cette bataille. Enterococcus faecalis est un coque Gram positif (Gram +), particulièrement redoutable. Il a été responsable de 6,5 % des infections nosocomiales en France en 2017, juste derrière les célèbres Escherichia coliEscherichia coli et Staphylococcus aureusStaphylococcus aureus. Cette souche est particulièrement tenace car elle possède un système de résistancerésistance assez incroyable.
Grâce à un effecteur qui repère les agents antibactériens dans le milieu extra-cellulaire, Enterococcus faecalis est capable de modifier la structure de sa membrane en un éclairéclair pour empêcher leur action. La description détaillée de ce mécanisme a fait l'objet d'une publication dans la revue PNAS.
LiaX, le détecteur d’agents antibactériens
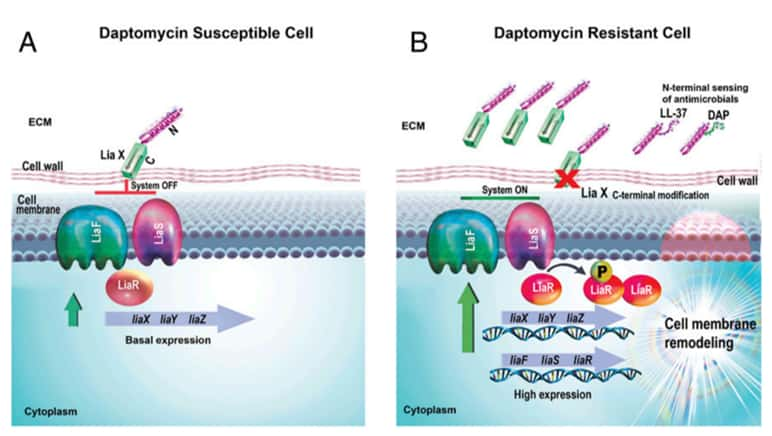
Le système de résistance d'E. faecalis, appelé LiaFSR, est une réponse de la bactérie pour se protéger de différents stress qui menacent sa membrane cellulairemembrane cellulaire et donc sa survie. Il est présent chez les souches résistantes à la vancomycine, un antibiotique qui empêche la formation de la paroi des bactéries Gram +, ce qui les rend d'autant plus difficiles à tuer. « LiaX, un effecteur du système LiaFSR, est spécifique des entérocoques résistant à la vancomycine. Il est présent dans E. faecalis et E. faecium », explique Ayesha Khan, une doctorante au centre de recherche médical de l'université du Texas ayant participé à l'étude.
Comment cela fonctionne-t-il ? La moléculemolécule LiaX est intégrée dans la paroi de la bactérie, avec une partie (qu'on appelle N-terminale) tournée vers le milieu extra-cellulaire et une autre (C-terminale) qui contrôle le reste du système. Quand une molécule antibactérienne approche, ici des peptidespeptides antimicrobiens produits par l'immunitéimmunité innée et la daptomycine, un antibiotique liposoluble, LiaX va les reconnaître et les capturer. Suite à cela, le système LiaFSR s'active et produit des facteurs de transcriptiontranscription qui informent la bactérie de la menace. En réponse, elle modifie la localisation et la structure des phospholipidesphospholipides anioniques de sa membrane.
“Les bactéries s'adaptent aux antibiotiques en quelques jours, parfois moins !”
Ce changement majeur de structure ne prend que quelques heures ! « C'est très rapide ! En général, les bactéries s'adaptent aux antibiotiques et aux antimicrobiens en quelques jours et parfois en quelques heures. Dans ce cas, nous avons observé au labo que les cellules étaient capables d'évoluer et de changer leur membrane en quelques jours », indique Ayesha Khan. Les molécules antimicrobiennes ont perdu leur cible d'attaque et la bactérie survit.
En désactivant le système de défense LiaFSR, les entérocoques ont retrouvé leur sensibilité à la daptomycine. « Nous avons montré que cibler ce système de réponse au stress est une stratégie viable pour restaurer la sensibilité des bactéries aux antibiotiques existants. C'est une preuve de concept pour des molécules antimicrobiennes "anti-adaptation". »
Limiter l’évolution de la bactérie pour mieux la vaincre
Selon les chercheurs, ce mécanisme est une cible potentielle pour de nouvelles molécules thérapeutiques. Car le système LiaFSR n'est pas natif, c'est le résultat d'une adaptation de certaines souches pathogènes à la pressionpression des antibiotiques mais aussi au système immunitairesystème immunitaire. « Il n'y aura jamais un antibiotique qui, seul, empêchera le développement de résistance », souligne Ayesha Khan.
La proposition des scientifiques de l'université du Texas est de développer des médicaments qui pourraient freiner la capacité évolutive de ces souches, et les empêcher de modifier leur membrane. « Par exemple, comme LiaX reconnaît le danger dans l'environnement extra-cellulaire, nous cherchons à savoir si on peut bloquer cette reconnaissance et prévenir la restructuration membranaire de la bactérie. Cela nous laisse assez de temps pour éliminer la souche avec d'autres agents antimicrobiens déjà existants », précise Ayesha Khan. Voilà de quoi imaginer de nouvelles stratégies d'attaque pour neutraliser les souches super résistantes.