au sommaire
La suite des 238 acides aminésacides aminés qui constitue la GFP ainsi que l'information génétiquegénétique qui lui correspond ont été décrites en 1992 par Douglas Prasher et ses collègues (Prasher et al. 1992). Peu de temps après, la surprise fut de taille lorsque Martin Chalfie et ses collaborateurs introduisirent en 1994 le gènegène de la GFP (Protéine fluorescente verteProtéine fluorescente verte) dans un nématodenématode, le rendant fluorescent lorsqu'il était exposé à une lumière bleue. C'était la démonstration pour la première fois, que le produit d'un seul gène se suffisait à lui-même pour rendre un organisme fluorescent.
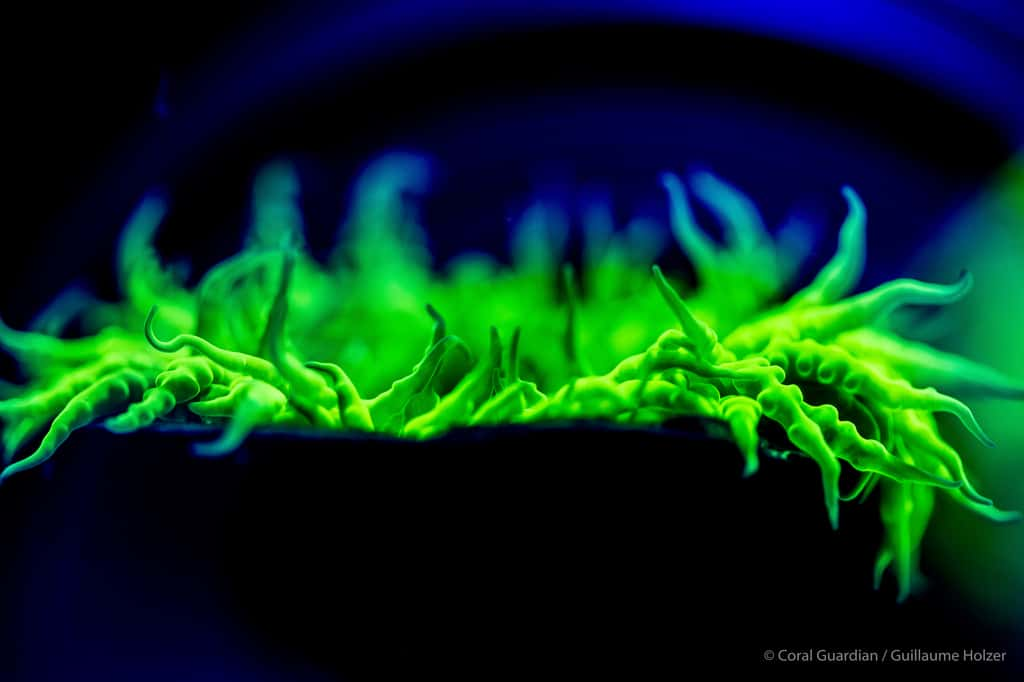
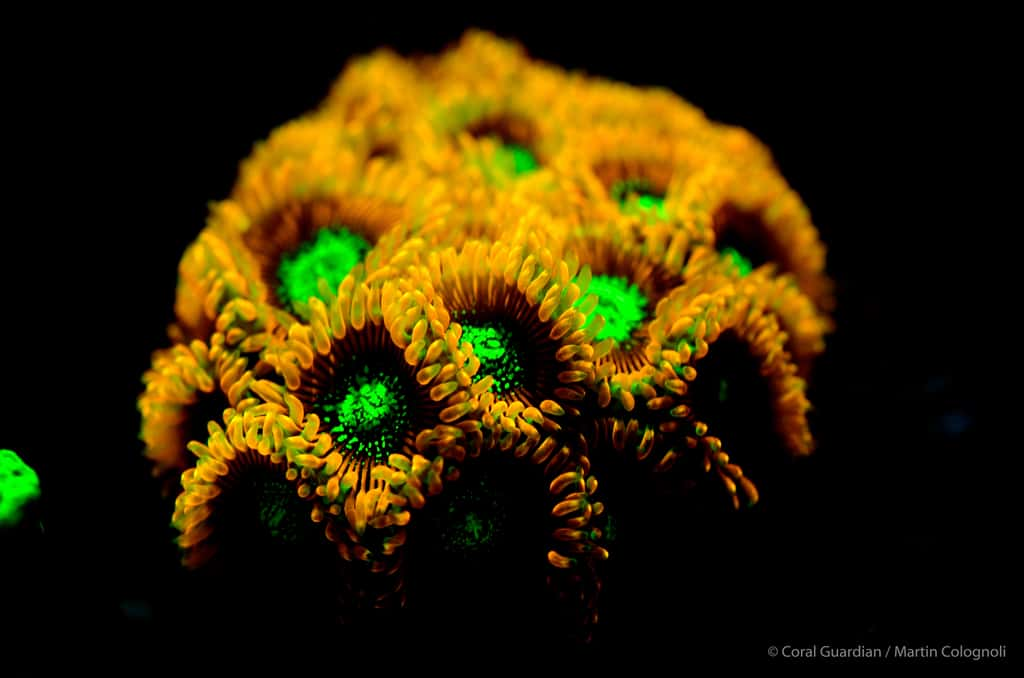
De nombreux organismes possèdent des protéines semblables à la Protéine fluorescente verte ou GFP (voir la page 2 de ce dossier) et sont appelés « GFP-like ». Bien que la séquence des acides aminés (les briques qui composent les protéines) varie considérablement d'une « GFP-like » à une autre, leur structure tridimensionnelle est remarquablement conservée.

Le chromophore responsable de la fluorescence
Le chromophore (centre actifcentre actif de la protéine qui est responsable de la fluorescence) implique systématiquement trois acides aminés spécifiques. Dans la GFP d'Æquorea victoria il s'agit d'une sérinesérine (Ser), d'une tyrosinetyrosine (Tyr) et d'une glycineglycine (Gly) ne nécessitant que l'oxygène pour réagir (Tsien 1998).
Pour les GFP-like, le chromophore comprend toujours l'association Tyr-Gly mais la sérine peut être remplacée suivant les cas par trois autres acides aminés (asparagineasparagine, glutamineglutamine ou lysinelysine). De très légères modifications au niveau de ces acides aminés suffisent donc à changer les spectres d'absorption et d'émission de ces protéines (Matz et al. 2005, Nienhaus et al.2000).

Dans certains cas, bien qu'il s'agisse toujours de GFP-like, la fluorescence disparaît même complètement et il ne subsiste qu'une simple protéine colorée (Wiedenmann, 1997, 1999). On connaît aujourd'hui plus d'une centaine de GFP-like dans les différents groupes de la systématique des invertébrésinvertébrés (Shagin et al 2004). De même les pigments non fluorescents des coraux durs qui ont été décrits sous le terme de « pocilloporine » sont à ranger dans une famille de GFP-like (Dove et al. 2001).
Tout comme la GFP, ces GFP-like sont codées par un gène unique, et pour l'activation des chromophores l'oxygène seul est nécessaire. Une exception est constituée par la protéine fluorescente rouge des coraux comme Lobophyllia hemprichii, Trachyphyllia geoffreyi et Montastrea cavernosa, dont les pigmentspigments nécessitent une photo-activation par des ondes courtes comprises entre 360 et 440 nm (Wiedenmann et al.2004/1, Wiedenmann & Nienhaus 2006, Oswald et al.2007, Leutenegger et al.2007).