au sommaire
Pour les molécules d'un gaz, il existe deux manières de changer d'état d'énergie, soit par la transformation d'énergie cinétique en l'une des formes discrétisées (l'énergie électronique, l'énergie de vibration et l'énergie rotationnelle) lors d'un choc avec une autre molécule, soit par absorptionabsorption ou émissionémission d'un photonphoton.
Niveau confirmé
Un photon est une particule élémentaireparticule élémentaire de la lumièrelumière, c'est-à-dire l'un des plus petits objets physiquesphysiques qui la compose. Il est absorbé quand son énergie permet à une molécule de passer d'un mode donné à un autre.
Absorption sélective
Ainsi l'énergie d'un photon peut évoluer selon l'équationéquation E = hν où ν est la fréquencefréquence de l'onde associée au photon. La molécule étant dans l'état d'énergie E1, le changement d'état d'énergie se produit quand il existe pour cette molécule un état d'énergie E2, tel que ΔE = E2 - E1 = hν. La molécule est alors dans un état excitéétat excité. Elle ne le reste jamais bien longtemps.
Excitation et désexcitation de la molécule
La molécule peut se désexciter de deux manières :
- soit en émettant spontanément un photon de même énergie, on parle alors de désexcitation radiative ;
- soit en passant au voisinage d'une autre molécule, à une distance telle que leurs dipôles électriques interagissent. Dans de ce dernier cas, l'énergie supplémentaire est transformée en énergie cinétique, c'est ce qu'on appelle une collision.
Dans le dernier cas, le processus inverse est possible. Il transforme alors de l'énergie cinétique en énergie radiative quand les interactions entre deux molécules proches provoquent une transition : la molécule est alors excitée par collision. Au bout d'un temps très court, elle est, à son tour désexcitée par l'un des deux processus et ainsi de suite. L'absorption de rayonnement augmente l'énergie cinétique moyenne et donc la température, l'émission aboutit au phénomène inverse.

La couleur verte dominante est due à la désexcitation des atomes d'oxygène de la haute atmosphère ionisés par le vent solaire. © Esa
Durée de vie de l'état excité
Le temps pendant lequel la molécule reste dans l'état excité s'appelle la duréedurée de vie de l'état excité. Dans le cas de la désexcitation radiative, c'est-à-dire par émission spontanée, on parle aussi de durée de vie naturelle, elle peut être déterminée à partir du coefficient d'absorption ou du coefficient d'EinsteinEinstein d'émission spontanée. Elle est proportionnelle au cube de la longueur d'ondelongueur d'onde. Pour les collisions, la durée de vie dépend de la densité de molécules et de leur agitation, c'est-à-dire de la pressionpression et de la température.
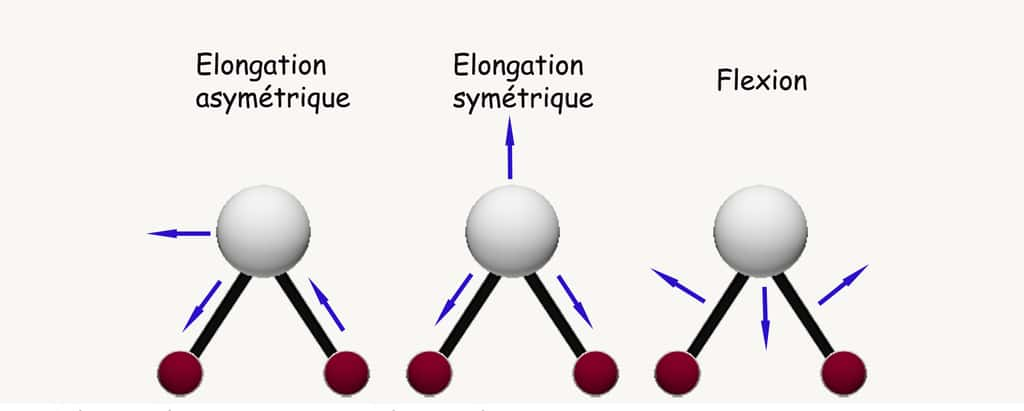
Les différents types de transitions
- Les transitions entre les niveaux électroniques (ΔEe) sont les plus énergétiques, la fréquence ν de la transition se situe dans l'UVUV ou le visible ;
- les transitions entre états de vibration (ΔEv) sont situées dans le proche infrarougeinfrarouge (IR) ;
- les transitions d'un état de rotation (ΔEr) à un autre sont les moins énergétiques et se situent dans l'IR et les micro-ondes.
Lors d'une collision, une molécule peut subir en même temps les trois types de transition. Il en va de même si elle interagit avec un photon de fréquence ν tel que hν est une combinaison de ΔEe, ΔEv, ΔEr.