au sommaire

Tumeur d'Ewing - Découverte d'un chaînon du développement tumoral
Ayant déjà identifié l'altération à l'origine de la tumeurtumeur d'Ewing, un cancercancer de l'os qui touche de jeunes patients, une équipe de l'Inserm à l'Institut Curie vient de mettre en évidence, grâce à la combinaison de techniques novatrices, 86 gènesgènes dérégulés dans ces tumeurs. Un de ces gènes, nouveau « chaînon » du développement de la tumeur d'Ewing, pourrait devenir une cible thérapeutique.
Ces découvertes sont publiées dans Molecular and Cellular Biology d'août 2004.
Le cancer résulte de la prolifération de cellules anormales dans notre organisme. Son point de départpoint de départ est l'altération du matériel génétiquematériel génétique d'une seule cellule, dans certains gènes qui régulent les processus vitaux (division, différenciation, apoptoseapoptose, réparation).
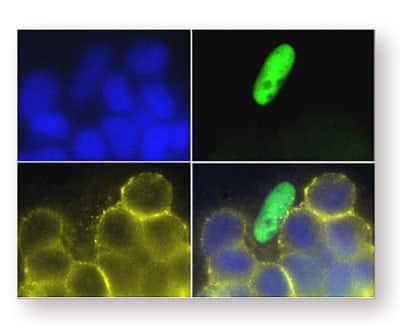
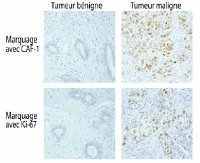
Dans ces cellules, les marquages en bleu, en vert et en jaune correspondent respectivement au noyau, à la protéine EWS/FLI-1 et à la protéine IGFBP-3. Dans les cellules où EWS/FLI-1 est présente (marquage vert), on n'observe pas de protéine IGFBP-3 (absence de marquage jaune), ce qui confirme que la protéine altérée EWS/FLI1 empêche le gène IGFBP-3 de s'exprimer. © A. Prieur/Institut Curie
Une seule mutation n'est cependant pas suffisante pour transformer une cellule saine en cellule cancéreuse. C'est une succession d'accidentsaccidents génétiques qui rend les cellules incontrôlées et leur permet de s'accumuler pour finalement former une tumeur.
Rares sont les cancers pour lesquels il existe une signature moléculaire simple - une mutation spécifique à l'origine du développement tumoraltumoral. Dans les tumeurs d'Ewing, une tumeur maligne de l'os qui atteint l'enfant, l'adolescent et le jeune adulte, cette signature moléculaire a été découverte grâce à l'étroite collaboration entre médecins et chercheurs de l'Institut Curie, le centre de référence de renommée internationale pour la prise en charge et la recherche sur cette pathologiepathologie.
Les chercheurs de l'Institut Curie montrent ainsi que dans la tumeur d'Ewing, la protéineprotéine altérée (EWS/FLI1) empêche le gène IGFBP-3 de s'exprimer. Par conséquent, le facteur de croissancefacteur de croissance IGF-1IGF-1 n'est plus "bloqué". "Libre de ses mouvements", IGF-1 transmet alors en continu un signal ordonnant aux cellules de proliférer. IGFBP-3, impliqué en amont dans cette voie de signalisation, pourrait servir de cible thérapeutique pour bloquer la prolifération cellulaire anormale induite par IGF-1.
Ils viennent donc de découvrir un nouveau « chaînon » du développement des tumeurs d'Ewing. C'est en connaissant mieux les cascades de dérèglements propres à chaque tumeur que de nouvelles stratégies thérapeutiques plus spécifiques et d'autant plus efficaces pourront être développées.
Ainsi, l'équipe d'OlivierOlivier Delattre a identifié et caractérisé cette mutation : il s'agit d'un échange accidentel de matériel génétique entre deux chromosomeschromosomes qui entraîne la formation d'un gène muté produisant une protéine anormale baptisée EWS/FLI-1
Pour comprendre le développement de la tumeur d'Ewing, l'équipe d'Olivier Delattre étudie maintenant les effets de cette protéine altérée sur la machinerie cellulaire. Pour cela, les chercheurs utilisent une approche originale qui consiste à « éteindre » le gène muté par la technique "d'interférence à l'ARNARN"2 : la protéine anormale n'est alors plus fabriquée. Grâce aux puces à ADNADN, ils observent les conséquences de l'absence de la protéine anormale sur les autres gènes.
Pour en savoir plus sur les tumeurs d'Ewing
Appelé aussi sarcomesarcome d'Ewing (le sarcome est une variété de cancer se développant aux dépens du tissu conjonctif), cette tumeur maligne de l'os atteint l'enfant, l'adolescent et le jeune adulte (jusqu'à 30 ans) avec un pic de fréquence à la pubertépuberté, entre 10 et 20 ans. On observe en France, de 50 à 100 nouveaux cas par an, ce qui en fait la deuxième tumeur de l'os en termes de fréquence chez les moins de 30 ans.
Le point de départ de la tumeur est la moelle osseusemoelle osseuse, ce qui explique sa répartition : essentiellement les os plats et la partie diaphysaire des os longs. Le potentiel métastatiquemétastatique est important et concerne surtout les poumonspoumons et le squelette.
En 30 ans, le traitement de la tumeur d'Ewing, à l'origine essentiellement basé sur la radiothérapieradiothérapie, a profondément évolué. Aujourd'hui, la stratégie thérapeutique utilisée pour venir à bout d'une tumeur localisée combine, dans la majorité des cas, chimiothérapiechimiothérapie et chirurgiechirurgie. Une chimiothérapie postopératoirepostopératoire, et parfois une radiothérapie, complète le traitement.
C'est à l'Institut Curie qu'a été découverte, en 1984, et caractérisée, en 1992, l'anomalie chromosomiqueanomalie chromosomique responsable de cette affection. Il s'agit d'une translocationtranslocation, c'est-à-dire d'un échange anormal de matériel génétique, entre deux chromosomes :
- Dans 85 % des cas, cette translocation se produit entre les chromosomes 11 et 22 et aboutit à la synthèse d'une protéine anormale EWS-FLI-1.
- Dans 10 % des cas, elle se produit entre les chromosomes 22 et 21 et donne lieu à la synthèse d'une protéine anormale EWS-ERG.
La découverte de ces altérations génétiquesaltérations génétiques a permis la mise au point, à l'Institut Curie en 1994, d'un test diagnosticdiagnostic de la tumeur d'Ewing. S'appuyant sur une étroite collaboration entre médecins et chercheurs, l'Institut Curie est devenu un centre de référence, de renommée internationale, pour la prise en charge clinique des jeunes patients atteints de tumeur d'Ewing et pour l'analyse moléculaire de ces tumeurs.
Référence
"EWS/FLI-1 silencing and gene profiling of Ewing cells reveals downstream oncogenic pathways and a crucial role for repression of IGFBP-3" Alexandre Prieur1, Franck Tirode1, Pinchas Cohen, Olivier Delattre