au sommaire
Un gène responsable d'une nouvelle forme de diabète
Le diabète néonatal (DN) est défini par une hyperglycémie survenant dans les premiers jours ou mois de la vie, et nécessite le recours à une insulinothérapie. Contrairement au diabète de type 1 (1), il ne s'agit pas d'une maladie auto-immune. Deux formes cliniques distinctes de DN sont décrites : une forme permanente (DNP) qui requiert un traitement tout au long de la vie, et une forme transitoire (DNT) montrant une rémission précoce entre une semaine et une année de vie, avec possible réapparition du diabète, notamment lors de la puberté. Plusieurs défauts moléculaires responsables de ces 2 formes de diabète néonatal ont déjà été mis en évidence, mais n'expliquent qu'une partie des cas étudiés.

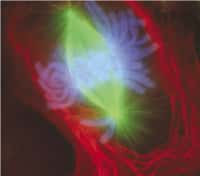
Poste de patch-clamp, mise en place d'une coupe de cerveau de souris sous microscopie avant la mise en place des électrodes. L'objectif de cette expérience est le contrôle nerveux de l'homéostasie énergétique et de la prise alimentaire, et l'identification de son dysfonctionnement dans les pathologies métaboliques (obésité, diabète).
© CNRS Photothèque / PERRIN Emmanuel
Les sulfamides sont des antidiabétiques oraux qui augmentent la sécrétion de l'insulineinsuline et favorisent donc une meilleure régulation de la glycémieglycémie. Les équipes de Philippe Froguel et de Michel Polak, en collaboration avec le Baylor College of Medicine viennent d'identifier et de caractériser des mutations activatrices du gènegène du récepteur aux sulfamides, ABCC8/SUR1, situé sur la cellule b pancréatique.
En collaboration avec le réseau français pour l'étude du diabète néonatal, coordonné par Michel Polak, l'équipe franco-américaine a séquencé les 39 exonsexons constituant le gène du récepteur aux sulfamides SUR1 chez 34 enfants présentant tous un diabète néonatal non expliqué par une anomalieanomalie géniquegénique connue. Neuf enfants (deux présentant un DNP et sept présentant un DNT) se sont révélés porteurs d'une mutation de ce gène. Dans 4 cas, la mutation a été transmise par un parent (ces derniers n'ayant cependant développé un diabète qu'à l'adolescenceadolescence ou à l'âge adulte). Les 5 autres cas étaient porteurs de mutations nouvelles non présentes chez leurs parents. Les sulfamides ont un effet inhibiteur sur le canal potassique de la cellule b pancréatique, impliqué dans l'exocytoseexocytose de l'insuline. Lorsque le récepteur aux sulfamides est muté, des analyses électro-physiologiques ont permis de révéler que ce canal potassique reste ouvert et bloque la sécrétion de l'insuline. Cependant, les canaux mutés restent sensibles aux sulfamides. Ceci laisse envisager une alternative à l'insulinothérapie de ces enfants, que l'on croyait définitive, en lui substituant un traitement oral par un sulfamide hypoglycémiant. Ce dernier point vient d'être renforcé par la possibilité d'arrêter l'insulinothérapie dans un groupe de 44 patients sur 49 présentant une autre anomalie du canal potassique. Ces travaux menés par les équipes de Michel Polak, Pal Njolstad et Andrew Hattersley, font l'objet d'une seconde publication dans The New England Journal of Medicine.
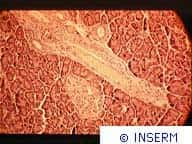
Chaîne C-alpha d'une alpha-amylase pancréatique, montrant les trois domaines structuraux et la région du site actif fixant un médicament anti-diabète (l'acarbose). Programme IMABIO.
© CNRS Photothèque / HASER Richard
Ces résultats précisent les mécanismes de l'insulino-sécrétion induite par le glucoseglucose. Ils ont des implications cliniques immédiates : un diagnosticdiagnostic génétiquegénétique de ces nouvelles formes de diabète de type 2 et un changement radical de traitement. Les chercheurs montrent donc qu'une forme rare de diabète de l'enfant peut aider à mieux comprendre la physiopathologie du diabète plus commun chez l'adulte et conduire à une nouvelle médecine individualisée basée sur une analyse génétique.
Notes :
(1) Diabète insulino-dépendant, du à la destruction auto-immune des cellules du pancréaspancréas. Le diabète de type I (10% des cas) peut être traité par des injections régulières d'insuline, à vie. Le diabète de type II (90% des cas), non insulino-dépendant, ou diabète "gras", est une maladie métabolique qui se caractérise par un excès de sucresucre dans le sang. Il touche principalement les personnes à l'âge adulte ou présentant un surpoidssurpoids marqué, mais devient de plus en plus fréquent chez l'enfant et l'adolescent.
Si vous-même ou vos enfants souffrez de Diabète (de type 2) ou d'ObésitéObésité, vous pouvez aider la recherche en appelant le N° Vert 0 800 02 04 12 ou d'un diabète non auto-immun, si il s'agit d'un enfant, en appelant le 01 44 49 48 02.
Références :
Activating Mutations in ABCC8 cause Neonatal Diabetes Mellitus. Babenko AP*, Polak M*, Cavé H, Busiah K, Czernichow P, Scharfmann R, Bryan J, Aguilar-Bryan L, Vaxillaire M, Froguel P. N Engl J Med 2006
Successful Transfer of Patients with Diabetes due to Mutant Kir6.2 from Insulin to Oral Sulfonylureas. Ewan R Pearson*, Isabelle Flechtner*, Pål R Njølståd*, Neonatal diabetes international collaborative group, Maciej T Malecki, Sarah E Flanagan, Brian Larkin, Frances M Ashcroft, Iwar Klimes, Ethel Codner, Violeta Iotova , Annabelle S Slingerland, Julian Shield , Jean-Jacques Robert , Jens J Holst, Penny M Clark, Sian Ellard, Oddmund Søvik, Michel Polak M, Andrew T Hattersley. N Engl J Med 2006
Contacts :
Chercheurs
Philippe Froguel
T 06 07 89 30 92
[email protected]
Martine Vaxillaire
T 03 20 87 10 68
[email protected]
Michel Polak
T 01 44 49 48 02
[email protected]
Presse
CNRS
Isabelle Bauthian
T 01 44 96 46 06
[email protected]
INSERM
Anne Mignot
T 01 44 23 60 73
[email protected]