au sommaire
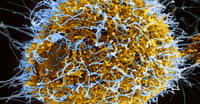
Lymphocytes B visualisés en microscopie confocale (x 1.000). Le cytosquelette (molécules d’actine) est marqué par une sonde fluorescente verte (phalloïdine FITC). Les lymphocytes B avec une IgM à leur surface ont des protubérances (pseudopodes) témoignant de leur mobilité alors que les lymphocytes B IgE+ perdent ces structures et deviennent immobiles. © CNRS, laboratoire « Contrôle de la réponse immune B et lymphoproliférations »
L'immunité repose sur des cellules, les lymphocytes B, portant ou sécrétant des armes antibactériennes ou antivirales, les immunoglobulines (IgG, IgM, IgA, IgEIgE) ou anticorps. Si elles nous protègent, elles peuvent aussi parfois se retourner contre nous. C'est le cas pour les plus efficaces des anticorps, les IgE, dont même des traces infimes (ces IgE sont 100.000 fois moins abondants que les autres anticorps) peuvent déclencher des réactions allergiques très violentes.
Les lymphocytes producteurs d'IgM, IgG ou IgA sont nombreux, aisément identifiables et persistants (en tant que cellules mémoires). Pour des raisons jusqu'ici inexpliquées, les cellules productrices d'IgE sont rares et ont donc été très peu étudiées. Afin de comprendre les mécanismes de contrôle des IgE, les chercheurs ont tout d'abord contraint, par génie génétique, des cellules à produire ces anticorps en grand nombre. Ils ont alors réussi à mettre en évidence deux mécanismes majeurs de contrôle. Ils ont démontré que dès qu'un lymphocyte B porteporte sur sa membrane une IgE, il se fige : il s'arrondit, perd ses pseudopodes (déformations de la membrane qui permettent à une cellule de se nourrir et de se déplacer en rampant) et devient incapable de se mouvoir, alors que les lymphocytes sont habituellement très mobilesmobiles. Les scientifiques ont également révélé que le lymphocyte active plusieurs mécanismes d'apoptose, la mort programmée de la cellule. Cette autodestruction provoque l'élimination rapide des lymphocytes porteurs d'IgE tandis que les autres cellules du système immunitaire sont capables de survivre jusqu'à plusieurs années.
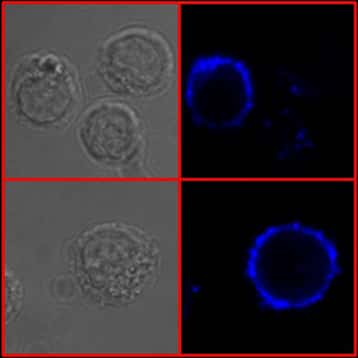
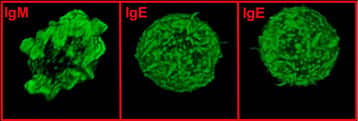
Internalisation des IgE membranaires (endocytose spontanée) contribuant à une expression faible de l’IgE et à la mort de ces cellules. Visualisation en microscopie confocale (x 1.000) de lymphocytes B IgE+ incubés à 37 °C avec des anticorps anti-IgE. Ce marquage permet de mettre en évidence un phénomène d’internalisation des IgE membranaires visualisées en bleu (droite). © CNRS, laboratoire « Contrôle de la réponse immune B et lymphoproliférations »
Le système immunitaire s'autocensure
Notre organisme a donc développé, au cours de l'évolution, plusieurs systèmes d'autocensure autour d'une de ses armes immunitaires les plus puissantes, l'IgE. Comme la cellule porteuse de celle-ci ne peut plus se déplacer, elle ne peut survivre que durant un temps bref, suffisant pour jouer un rôle protecteur ponctuel contre les parasitesparasites, les toxinestoxines et les veninsvenins. Elle s'autodétruit ensuite par une sorte de « hara-kiri », lequel limite très fortement la production des IgE et donc le déclenchement d'allergies. Les chercheurs souhaitent désormais explorer plus avant les différentes voies moléculaires de cette autocensure. Elles sont en effet autant de nouvelles cibles thérapeutiques dont l'activation pharmacologique pourrait contrer les allergiesallergies, voire permettre de censurer d'autres lymphocytes B pathologiquespathologiques, comme ceux impliqués dans les lymphomeslymphomes.
Les résultats de cette étude menée par des chercheurs du CNRS, de l'Inserm et de l'université de Limoges au sein du laboratoire « Contrôle de la réponse immune B et lymphoproliférations » (CNRS, université de Limoges) ont été publiés en ligne dans la revue Cell reports, le 12 février 2015.