au sommaire

L'appareillage de l'équipe de Daniel Nocera, encore à l'état de prototype. © MIT/NSF
Au Massachusetts Institute of Technology (MIT), Daniel Nocera et ses collègues s'obstinent à réussir une réaction chimiqueréaction chimique que les plantes vertes effectuent tant qu'il y a du soleilsoleil : la cassure de la moléculemolécule d'eau en ses deux constituants, l'hydrogènehydrogène et l'oxygène. Réalisée dans les feuilles grâce à la chlorophyllechlorophylle (ou à des pigments différents chez d'autres organismes photosynthétiques) et à l'énergieénergie apportée par la lumièrelumière, elle constitue l'une des deux réactions de la photosynthèsephotosynthèse, l'autre étant la transformation du gaz carboniquegaz carbonique (CO2) en une molécule organique qui servira à fabriquer des sucressucres.
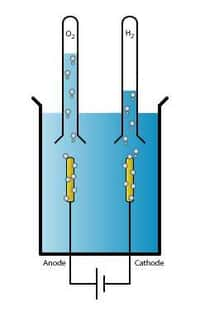
On sait depuis longtemps la réaliser en apportant de l'énergie sous forme électrique. C'est l'électrolyseélectrolyse. En plongeant deux électrodesélectrodes dans l'eau et en appliquant une tension suffisante, on obtient un dégagement d'oxygène à l'anodeanode et d'hydrogène à la cathodecathode. Mais l'idée d'effectuer la réaction sans autre apport d'énergie que celle du soleil hante les laboratoires depuis longtemps.
L'hydrogène, que l'on commence à savoir enfermer dans des réservoirs, est bien plus commode à stocker que l'électricité. On peut ensuite récupérer l'énergie ainsi mise en réserve, par exemple dans une pile à combustibles où s'effectue la réaction inverse, produisant de l'eau et du courant électriquecourant électrique. L'hydrogène peut aussi être utilisée par d'autres moyens. L'énergie solaire pourrait alors être utilisée de manière plus souple qu'en produisant de l'électricité au gré de l'ensoleillement.
A la recherche du catalyseur
Mais il reste encore un long chemin à parcourir pour égaler l'efficacité des plantes vertes. L'électrolyse réclame énormément d'énergie alors que la photosynthèse se contente de peu. Si l'on parvient à trouver un moyen pour réaliser l'électrolyse avec une quantité d'électricité suffisamment faible, celle-ci pourrait être alors fournie par des cellules solaires. Les chercheurs sont persuadés que la solution se trouve dans le domaine de la chimiechimie et en particulier des catalyseurscatalyseurs, ces molécules capables d'accélérer considérablement une réaction chimique sans être elles-mêmes altérées.
L'équipe de Daniel Nocera vient de présenter une remarquable avancée dans ce domaine en mettant au point un catalyseur à la fois efficace et bon marché. Alors que les recherches précédentes suivaient la piste d'un matériaumatériau à la structure maîtrisée, celui des chercheurs du MIT est amorpheamorphe et se forme de lui-même en s'accumulant spontanément autour de l'électrode (l'anode, en l'occurrence). Cette dernière est constituée d'un oxyde d'étainétain et d'indiumindium, plongée dans une solution contenant du phosphate de potassiumpotassium et du cobaltcobalt. Sous l'action du champ électriquechamp électrique, ces éléments s'accumulent autour de l'anode où ils deviennent un catalyseur très efficace pour rompre la molécule d'eau et produire de l'oxygène gazeux, qui s'échappe, et des ionsions d'hydrogène, qui restent dans la solution.
« Nocera a probablement retiré du travail à beaucoup de chercheurs » plaisante Karsten Meyer, chimiste à l'université Friedrich Alexander (Allemagne), qui s'exprime dans la revue du MIT et n'hésite à qualifier cette réalisation de « plus grande découverte du siècle » dans le domaine de l'énergie solaire.
Une électrode en plastique
Côté cathode, en revanche, là où doit être produit l'hydrogène gazeux (et les ions en oxygène qui restent en solution), le catalyseur utilisé par l'équipe est le platineplatine, un élément rare dont il est inutile de rappeler le coût. Mais les laboratoires mondiaux ne chôment pas et, dans le même temps, à des milliers de kilomètres de là, une autre équipe, celle de Bjorn Wintehr-Jensen et ses collègues de l'université Monash, à Clayton (Australie), mettaient au point un catalyseur en plastiqueplastique. Ces chercheurs ont en effet remplacé l'onéreux platine par un polymèrepolymère, variante du polyéthylènepolyéthylène, le poly(3,4-ethylenedioxythiophene), alias PEDOT, appliqué sur une membrane en Goretex. Elle fonctionne au contact de l'airair (l'électrolyte étant de l'autre côté) et offre une surface considérable. Il ne faut plus de platine mais tout de même une très faible quantité d'or, qui vient recouvrir les fibres de Goretex.
L'idée de l'électrolyse à faible consommation d'énergie avance donc à grand pas. La réalisation d'une production d'hydrogène à partir d'énergie solaire se rapproche assez nettement. Mais Daniel Nocera, et d'autres, ont toujours pour objectif d'imiter la photosynthèse et d'utiliser directement l'énergie des rayons solaires pour produire l'hydrogène. A regarder l'activisme des laboratoires du monde entier dans ce domaine, on peut conclure que cet objectif n'est ni utopique ni très éloigné...