au sommaire
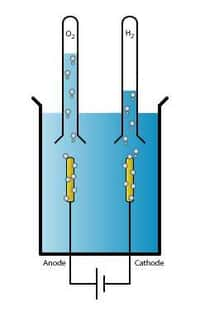
Il existe différents moyens de produire de l’hydrogène, notamment l'électrolyse, qui revient à décomposer de l'eau (H2O) en oxygène (O2)) et en hydrogène (H2). C'est d'ailleurs l'une des briques de la réaction de photosynthèse. Dans l'industrie, on utilise habituellement un courant électriquecourant électrique pour décomposer l'eau. Et si cette électricité est produite à partir d'une énergie renouvelableénergie renouvelable, comme l'énergie solaire, alors l'hydrogène obtenu peut être classé du côté des énergies vertesénergies vertes. Dans la réalité, malheureusement, les choses sont moins simples que sur le papier. Notamment parce que les réactions en jeu dans l'électrolyse sont lentes, très lentes... Ce qui rend le procédé économiquement très peu compétitif.
Des chercheurs de l'université de Stanford et du SLAC National Accelerator Laboratory sont partis en quête d'un catalyseur qui pourrait accélérer les réactions. Grâce à des simulations informatiquessimulations informatiques, ils ont pu concevoir un oxyde de strontium et d'iridiumiridium -- un élément rare -- susceptible de répondre à leurs besoins.
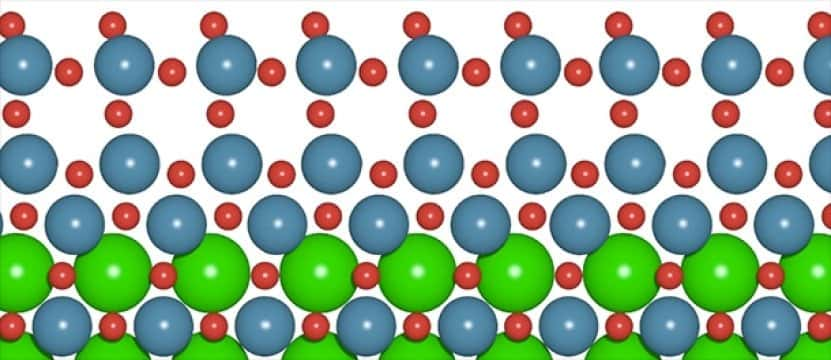
Sur cette illustration, les atomes de strontium (en vert) ont disparu de la couche supérieure du catalyseur sous l’effet de la corrosion, laissant un film d’oxyde d’iridium capable d’accélérer les réactions de façon spectaculaire. © C. F. Dickens, Stanford University
Un catalyseur cent fois plus efficace
À leur grande surprise, ce catalyseur s'est révélé plus efficace que prévu. Ses performances se sont même améliorées, pour atteindre des vitessesvitesses de réaction jusqu'à cent fois supérieures à celles des catalyseurs classiques, durant les deux premières heures d'utilisation. Pendant cette phase, un processus de corrosioncorrosion a libéré des atomesatomes de strontium dans le liquideliquide.
En quittant le métalmétal, ces atomes ont laissé derrière eux un film d'oxyde d'iridium de seulement quelques atomes d'épaisseur. Et, justement, ce film allégé est beaucoup plus efficace que le catalyseur initial.
Reste maintenant à comprendre les mécanismes précis de ce phénomène et à réduire encore la quantité d'iridium utilisée pour que ce catalyseur devienne réellement intéressant d'un point de vue économique.