au sommaire
Les mesures « destructives » classiques, réalisées en laboratoire, portent sur la phase solide (glace) ou la phase gazeuse (bulles d'air ou hydrates gazeux). Les cristaux de glace, par leur taille, dressent déjà un tableau qualitatif du climatclimat passé ; en particulier, la température de la glace influence leur vitesse de croissance. Mais les données quantitatives sont apportées par les compositions chimique et isotopique de la glace.

La composition isotopique de la glace détermine la température. Pour l'expliquer, partons d'une eau océanique qui s'évapore. Les molécules légères demandent moins d'énergie que les lourdes pour s'évaporer. En conséquence, la masse d'airmasse d'air humide est enrichie en isotopesisotopes légers alors que la mer s'enrichit en isotopes lourds. Cette masse d'air, transportée vers les pôles, se refroidit au cours de son voyage et son eau se condense au fur et à mesure. Sa vapeur s'enrichit d'autant plus en isotopes légers, les lourds étant préférentiellement emportés dans les pluies.
Teneur isotopique et température
La relation entre teneur isotopique et température est liée à la pressionpression de vapeur saturante de l'eau et de ses isotopes qui dépend de la température. Plus la température du lieu de condensationcondensation est basse, plus le fractionnement est important : plus la vapeur s'appauvrit en isotopes lourds et la phase solide s'enrichit en isotopes lourds. Arrivées à destination, les neiges qui tombent sur les pôles renferment de 3 à 5 % d'oxygèneoxygène 18 (18O) en moins que la source océanique.

Les mesures actuelles fournissent la relation existant entre la température atmosphérique et la composition isotopique et définissent donc un thermomètrethermomètre isotopique.
Au final, la composition isotopique de la neige des calottes polairescalottes polaires dépend linéairement de la température de l'air au moment de la précipitation neigeuse : le principe, extrapolé, donne accès aux températures du passé.
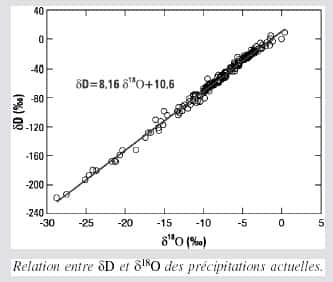
En effet, les coefficients de fractionnement à l'équilibre pour le deutérium et l'oxygène 18 ont un rapport d'environ 8, qui contraint au premier ordre un facteur 8 entre les compositions des précipitationsprécipitations dans ces deux isotopes (pente de la droite dite « des eaux météoriques », mesurée à l'échelle planétaire dans les précipitations échantillonnées par l'Agence internationale de l'énergie atomique).
Au second ordre, dans les processus de fractionnement hors équilibre (évaporation à la surface de l'océan, formation des cristaux de glace), apparaît un fractionnement cinétique supplémentaire dû aux différences de diffusivité des divers isotopes. Cet effet de second ordre justifie la définition de l'excès en deutérium. À l'évaporation, ce fractionnement cinétique appauvrit moins la vapeur formée en deutérium qu'en oxygène 18, et dépend des conditions d'évaporation : température de surface, mais également humidité relative de l'air et vitesse du vent. Les modèles de distillationdistillation et les modèles de circulation générale de l'atmosphèreatmosphère incluant les isotopes stables de l'eau montrent que le signal de l'évaporation dans l'excès en deutérium est conservé le long de la trajectoire des masses d'air jusqu'aux pôles.
Au second ordre, le fractionnement isotopique n'est pas exactement le même pour l'hydrogènehydrogène et l'oxygène, et l'excès en deutérium dépend de la température de la source océanique des neiges polaires.

































