au sommaire
Les suspensions sont des mélanges de particules solides dans un liquide. Lorsque ces particules sont suffisamment grosses, leur impact principal sur la viscosité du mélange est une augmentation (assez lente avec la concentration solide), simplement liée au fait qu'elles occupent un volume précédemment occupé par du liquide et qui ne peut désormais plus s'écouler.

L'effet de la simple présence de particules dans un liquide peut cependant devenir négligeable devant d'autres effets si les particules sont suffisamment petites, car elles développent alors des interactions à distance, autrement dit des interactions colloïdales, au sein du liquide. Ces effets colloïdaux commencent à jouer un rôle lorsque la taille des particules est inférieure à environ 100 µm, mais ne deviennent prédominants de façon certaine que pour des particules d'une taille inférieure à 1 µm. On trouve des particules colloïdales dans une multitude de produits industriels. Il en est ainsi des particules de silicesilice dans les dentifrices, des billes de latex et des pigmentspigments dans les peintures, des argilesargiles dans les crèmes cosmétiques, des nanoparticulesnanoparticules dans les pâtes de cimentciment, etc.

Les particules colloïdales naturelles les plus répandues à la surface de la Terre sont les argiles, issues de la décomposition chimique ou mécanique des roches. Les argiles sont l'un des composants fondamentaux des boues naturelles, des boues de forage, et entrent dans la composition de nombreux produits industriels (cosmétiques, céramiquescéramiques, papeterie, enduits, etc.).
Forces de van der Waals et colloïdes
Les interactions colloïdales sont en premier lieu les forces de van der Waals, qui tendent à faire s'agréger les particules entre elles, comme deux atomesatomes ou deux moléculesmolécules dans un liquide. Lorsque ces forces sont prédominantes, la suspension n'est pas stable, les particules tendent à se « coller » les unes aux autres pour finalement former un amas compact au fond du récipient de liquide. Dans ce cas, un simple mélange ne suffit pas à disperser à nouveau les particules, car les forces d'attraction dans ces collages sont très élevées.
Pour assurer une dispersion homogène des particules dans le liquide, il est nécessaire d'introduire des forces de répulsion suffisantes entre les particules colloïdales. C'est notamment le cas lorsque des ionsions sont adsorbés à la surface des particules : des forces de répulsion électrostatiquesélectrostatiques peuvent ainsi se développer entre les surfaces chargées de particules voisines. Une autre solution consiste à couvrir les particules de polymères qui, attachés à la surface de la particule par l'une de leurs extrémités, forment alors une sorte de « chevelure ». Les chevelures de deux particules voisines s'interpénètrent difficilement et tendent à maintenir à distance ces particules, les empêchant de se coller les unes aux autres. La superposition de ces différentes interactions peut conduire à un mécanisme d'agrégation faible : les particules voisines se placent à une distance qui correspond à l'équilibre des forces répulsives et attractives. On peut alors considérer que les particules sont en lien les unes avec les autres, mais ces liens peuvent facilement être brisés puis se reformer au cours de l'écoulement du matériaumatériau. Ces différentes techniques permettent d'assurer la stabilisation de la dispersion colloïdale.
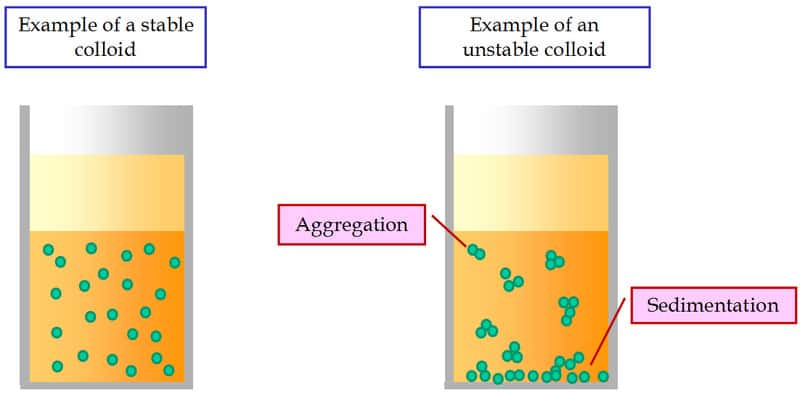
Si les particules sont assez nombreuses, elles forment un réseau continu de liens à travers tout l'échantillon. Ce réseau conduit à un comportement complètement différent de celui du liquide seul. Désormais, au repos, on a affaire à une structure solide que l'on ne peut briser qu'en appliquant un effort supérieur à une valeur critique : le fluide possède ce que l'on appelle un seuil de contrainte. Tant que la contrainte appliquée est inférieure à ce seuil, le matériau se comporte comme un solide : il se déforme de manière finie. Lorsqu'on applique une contrainte supérieure à ce seuil, le matériau s'écoule comme un fluide visqueux. Cependant, cette transition est réversibleréversible : si on abaisse progressivement la contrainte sous le seuil durant l'écoulement le fluide s'immobilise. Il ne se remettra à couler que lorsqu'on imposera une contrainte supérieure au seuil.
Des colloïdes parfois solides, parfois liquides
On est ainsi en présence d'un comportement assez déroutant par rapport au cadre de connaissances habituel qui sépare la matièrematière en deux classes principales, les solides et les liquides. Ces fluides à seuil se comportent comme des solides dans certaines circonstances, et comme des liquides dans d'autres circonstances. En dépit de ce comportement original, ces matériaux sont des fluides au sens où nous les avons définis plus haut : ils sont déformables à volonté sans perdre leurs propriétés mécaniques. Ce comportement à seuil n'est pas spécifique des suspensions colloïdales concentrées. On le rencontre également avec les moussesmousses, les gelsgels, les émulsionsémulsions concentrées. Il présente l'intérêt pratique de pouvoir donner au matériau une forme quelconque qu'il conserve en dépit des effets de la gravitégravité : placer un tronçon de dentifrice sur la brosse à dents, étaler une peinture sur murmur, étaler un bétonbéton, appliquer un mortier, décorer un gâteau avec de la crème chantilly, modeler des objets en pâte à sel, etc.
Une propriété remarquable de ces particules colloïdales est qu'une faible fraction volumique de telles particules en suspension dans un liquide peut donner un mélange ayant un seuil de contrainte très élevé, du fait que les particules exercent des forces mutuelles à des distances qui peuvent être de l'ordre de leur propre taille. Cet effet est utilisé par exemple pour toutes sortes de produits de revêtement et en cosmétique. La dispersion d'une faible fraction de particules de Laponite (une argile de synthèse) dans des peintures, gels, ou crèmes, a pour effet d'augmenter leur viscosité, voire leur donner un seuil de contrainte significatif. Néanmoins, ces particules très petites et en très faible concentration dans le mélange ont un impact négligeable sur les caractéristiques du produit final sec.





























