au sommaire
L'eau pure
- L'eau dans tous ses états :

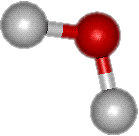
Molécule d'eau
L'océan est une mince pellicule à la surface de la terre. Il aurait une importance géophysique secondaire s'il n'était constitué d'eau à l'état liquideétat liquide. C'est la grande particularité de notre planète.
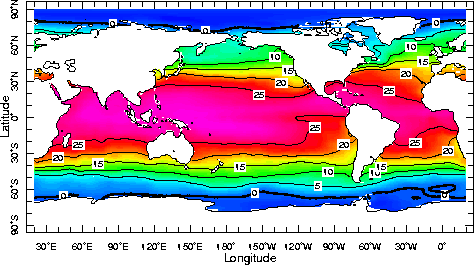
Sous ses trois états l'eau libre se répartie de la façon suivante :
97% dans les océans
~3% eau terrestre superficielle : cours d'eau, lac, glacierglacier, islandis
0,001% vapeur d'eau dans l'atmosphèreatmosphère
La masse totale est constante. Sont provisoirement fixées, les molécules qui entre dans la constitution des roches (les roches renferment en moyenne 1 à 2% d'eau).
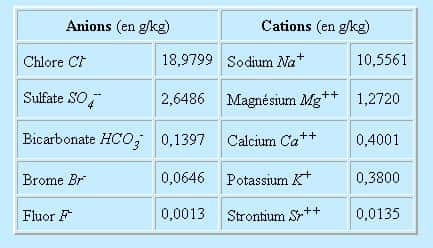
L'eau de mer est constituée de 96,5% d'eau pure et 3,5% d'autres substances comme les sels, les gaz dissous, les substances organiques et des particules solides. Ses propriétés physiques sont principalement dues aux 96,5% d'eau pure.
- Structure de la molécule d'eau:
L'eau, si on la compare à d'autres corps de composition analogue, possède des caractéristiques anormales. Considérons les corps dont les molécules sont constituées de deux atomes d'hydrogènehydrogène et d'un élément du groupe 16 de la table périodique (colonne dont fait partie l'oxygèneoxygène). Les températures de fusionfusion et d'ébullition de ces corps forment une série régulière (à cause des forces d'attraction de Van der Walls qui augmente en même temps que la masse moléculaire). L'eau fait exception à cette règle, comme le montre le tableau suivant.
La particularité de l'eau provient de sa structure moléculaire. Dans une molécule d'eau, un atome d'oxygène est lié à deux atomes d'hydrogène par des liaisons de covalence mettant en jeu un doubletdoublet d'électronsélectrons. L'angle O-H-O est voisin de 105°. La molécule est électriquement neutre mais est polarisée. En effet, la densité d'électrons est plus grande près du noyau d'oxygène que près des noyaux d'hydrogène.
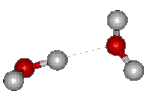
Fig.3.2 Liaison hydrogène
Lorsque deux molécules d'eau sont en présence, elles ont tendance à s'unir par une liaison électrostatiqueélectrostatique entre un noyau d'hydrogène chargé positivement et le nuagenuage électronique entourant le noyau d'oxygène. Cette liaison dite "liaison hydrogèneliaison hydrogène" a tendance à réaliser l'alignement H-O-H (figure 3.2).
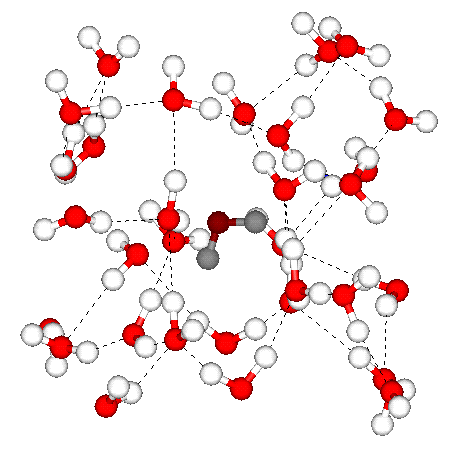
Fig. 3.3 : Assemblage des molécules d'eau
A 20°C les molécules d'eau s'assemblent en moyenne par 6 (figure 3.3). Cet assemblage de molécule justifie le changement de propriété de l'eau, qui se comporte comme un polymèrepolymère.
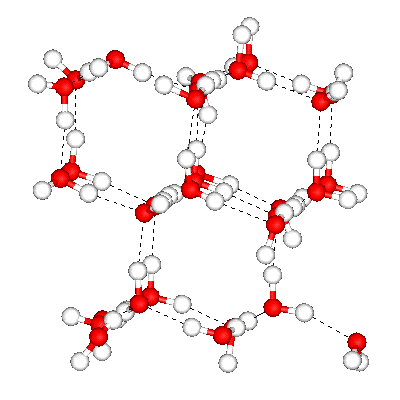
Fig. 3.4 : Structure de la glace
Dans la glace, toutes les molécules d'eau sont liées et forment une structure tétraédrique assez lâche (figure 3.4). La fusion de la glace entraîne un tassement des molécules.
Les différentes propriétés originales de l'eau découlent de la polarisation de la molécule d'eau et de l'existence de la liaison hydrogène.
- Les principales conséquences de la structure de la molécule d'eau sont les suivantes:
L'eau est le seul composé naturel qui existe sous les 3 états dans les conditions rencontrées à la surface de la terre. L'état liquide étant le plus fréquent. Le changement d'état se fait en rompant des liaisons hydrogène. Pour cela il faut fournir une énergieénergie importante, ce qui explique les valeurs élevées de chaleurschaleurs latentes de fusion et de vaporisationvaporisation de l'eau.
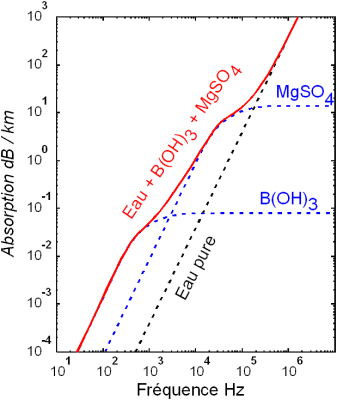
L'eau a une constante diélectriqueconstante diélectrique élevée. L'eau est le milieu naturel où le plus grand nombre de substances (minérales, organiques, à l'état gazeuxétat gazeux, liquides ou solides) peuvent se dissoudre et entrer en réaction. La conductivitéconductivité électrique de l'eau pure est relativement faible, mais celle de l'eau de mer est à mi-chemin entre celle de l'eau pure et du cuivrecuivre. A 20°C, la résistancerésistance de l'eau de mer salée à 3,5% sur une distance de 1,3 km est équivalente à celle d'1 mm d'eau pure.
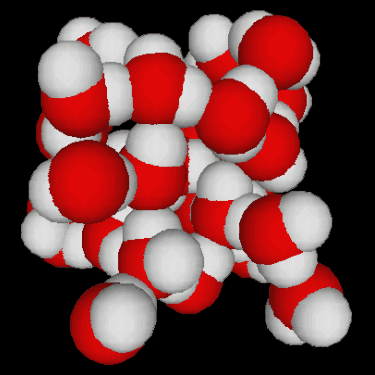
Fig.3.5 : Structures de l'eau
La congélation de l'eau s'accompagne d'une augmentation de volumevolume d'environ 10%. Ceci est dû à la structure tétraédrique de la glace, qui n'est pas le moyen le moins encombrant pour empiler des molécules (figure 3.5). Les conséquences géophysiques sont importantes :
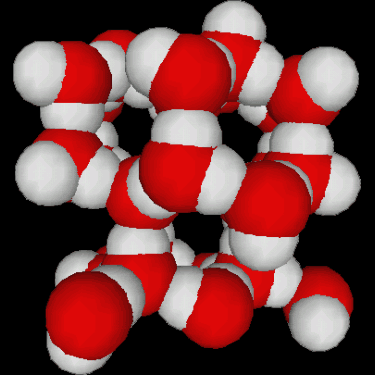
Fig.3.5 : Structures de l'eau
- La glace flotte. C'est important pour la vie dans les lacs. La glace reste en surface et agit comme un isolant, empêchant l'eau de geler de la surface jusqu'au fond.
- La densité de l'eau liquide diminue rapidement lorsqu'on s'approche du point de congélation. L'augmentation de volume qui en résulte est la cause de l'éclatement des roches.
- La température de congélation décroît avec la pressionpression. En conséquence, la fusion a lieu à la base des glaciers, ce qui facilite leur déplacement.
- La liaison hydrogène disparaît lorsque la pression augmente, la glace devient alors plastiqueplastique. C'est pourquoi les glaces de l'AntarctiqueAntarctique et de l'ArctiqueArctique s'écoulent vers la mer, créant des icebergs à leurs extrémités. Sans ce mécanisme, toute l'eau du globe finirait dans les régions polaires.
L'eau est peu compressible (comme tous les liquides). Mais si l'eau était rigoureusement incompressible, le niveau de la surface des océans serait plus élevé de 30 m. De plus le coefficient de compressibilité présente une anomalieanomalie, il diminue quand la température s'élève et passe par un minimum aux environ de 50°C.
La tension superficielle est la plus élevée de tous les liquides. C'est important pour la formation des gouttes d'eau et des vaguelettes.
Pour finir on peut noter que les propriétés physiques de la plupart des liquides varient uniformément avec la température. A l'opposée la plupart des propriétés de l'eau de mer présentent un minimum à une température donnée (sauf la céléritécélérité du son qui passe par un maximum à 74°C). Quelques exemples pour lesquels on donne la température correspondant au minimum :
- solubilité de l'oxygène : 80°C
- volume spécifique : 4°C
- chaleur spécifique : 34°C
- solubilité de l'hydrogène : 37°C
- compressibilité : 44°C
- vitesse de la lumièrevitesse de la lumière : -1°C
- Vitesse du sonVitesse du son : maxi à 74°C