au sommaire
L'électrolyse est un processus fondamental qui exploite les principes de la conductivité électrique pour effectuer des transformations chimiques contrôlées. Un courant électriquecourant électrique est utilisé pour provoquer une réaction chimique non spontanée. L'électrolyse est la décomposition chimique de certaines substances sous l'effet d'un courant électrique. Cette technique trouve de nombreuses applications dans la production industrielle, la métallurgie et la recherche en chimie.
Le principe de l'électrolyse
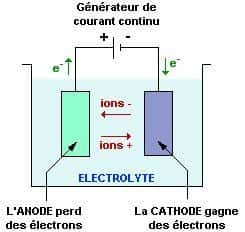
L'électrolyse repose sur la présence d'une solution électrolytique, généralement un liquide ionique ou une solution ionique, qui permet la conduction électrique. Deux électrodesélectrodes, l'anode et la cathodecathode, sont plongées dans cette solution. L'électrolyse se réalise dans une cuve contenant un électrolyte dans lequel sont plongées deux électrodes reliées aux bornes d'un générateurgénérateur de courant continucourant continu.
Lorsque le courant électrique circule à travers la solution électrolytique, les ionsions présents se déplacent vers les électrodes. On appelle anodeanode l'électrode reliée à la borne positive du générateur et cathode celle reliée à la borne négative du générateur. L'anode est l'électrode positive où des ions subissent l'oxydationoxydation, libérant des électronsélectrons, tandis que la cathode, est l'électrode où des ions subissent la réduction, captant ces électrons.
Ce qui provoque l'électrolyse
L'électrolyse est provoquée par l'application d'un potentiel électrique externe suffisamment élevé pour surmonter l'énergie d'activationénergie d'activation de la réaction redox (oxyréduction) non spontanée. Cela force la conversion d'ions en produits désirés aux électrodes, permettant la séparationséparation des composés chimiques présents dans la solution électrolytique.
Applications de l'électrolyse
L'électrolyse est largement trouve de nombreuses applications industrielles, elle est utilisée dans des domaines tels que la production d'aluminiumaluminium pour extraire ce métalmétal à partir de l'aluminealumine et la galvanoplastie. Dans le secteur chimique, elle est employée pour la synthèse de divers composés, l'électrolyse de l'eau est une méthode cruciale pour produire de l'hydrogène, une source d'énergie propre à partir de l'eau, la purification de substances, et la production de gazgaz.
L'électrolyse est également cruciale dans le stockage d'énergie, notamment dans les technologies émergentes telles que les piles à combustible et les systèmes de stockage d'énergie électrochimique.