au sommaire
Le terme nitrure renvoie, comme on l'imagine assez aisément, à des composés chimiques de l'azote, un corps qui entre largement dans la composition de l'air. Il en existe de nombreux et ils peuvent aussi bien être ioniques -- on appelle N3 -, ion nitrure -- que covalents.
Certains nitrures -- comme le nitrure de silicium (Si3N4), le nitrure de titane (TiN), le nitrure de bore (BN) ou le nitrure de tungstènetungstène (W2N, WN ou WN2) -- sont particulièrement appréciés par l'industrie du fait de leur grande duretédureté. Le nitrure d'aluminiumaluminium (AlN) quant à lui, est recherché pour sa grande conductivité thermiqueconductivité thermique et sa grande résistancerésistance à l'oxydationoxydation et à l'abrasionabrasion. Il est aussi utilisé pour ses propriétés piézoélectriquespiézoélectriques. Autres exemples : le nitrure de lithiumlithium (Li3N) qui peut agir comme une éponge pour l'absorptionabsorption ou la libération d'hydrogènehydrogène (stockage d’énergie) ou le nitrure de galliumgallium (GaN) -- on en trouve dans les LED -- qui est utilisé comme semi-conducteursemi-conducteur à large bandeà large bande interdite.
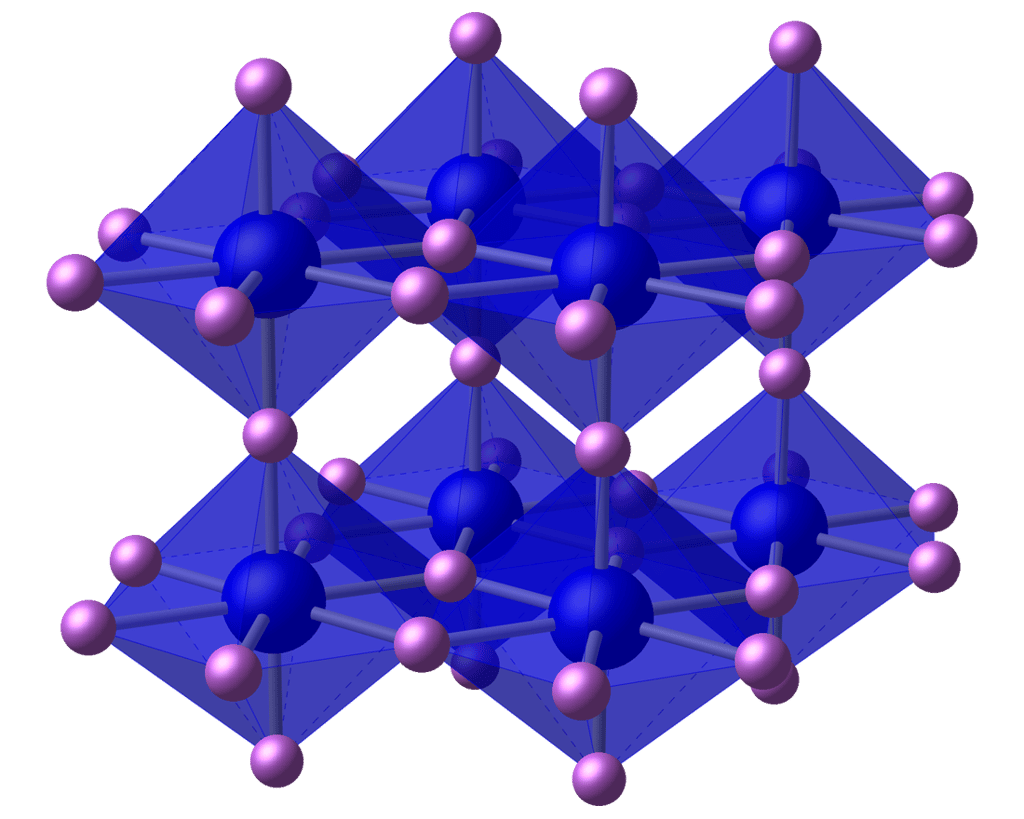
La structure du nitrure de lithium. Les anions nitrures sont en bleu, les cations lithium en rose. © Ben Mills, Wikipedia, Domaine public
Différents types de nitrures
La forte électronégativité de l'azote lui permet de former une structure ionique avec des métauxmétaux. Ainsi, des nitrures métalliques peuvent apparaître lorsque du diazote réagit avec des métaux à haute température. Certains nitrures -- comme le nitrure de niobiumniobium -- sont des supraconducteurs.
Lorsque des éléments non métalliques se lient à l'azote, en revanche, ils ne forment généralement pas de nitrures. Pour cela, il faut que l'élément en question affiche une électronégativité inférieure à celle de l'azote. Il est à noter que les nitrures non métalliques sont uniquement covalents. Ils ne sont jamais ioniques.