au sommaire
Est appelée « liaison chimique » une interaction attractive entre des atomes. L'origine de cette attraction peut être électrostatiqueélectrostatique (liaison ionique, liaison hydrogène) ou quantique (liaison covalente, liaison métallique, liaison de Van der Waals). Le but est, à chaque fois, de minimiser les énergiesénergies.
Les liaisons chimiques peuvent être classées en fonction de leur énergie de liaison.
Liaisons chimiques fortes : liaison covalente, liaison métallique…
Pour être brisées, les liaisons chimiques fortes nécessitent le recours à des énergies de quelques centaines de kilojoules par molemole.
Sont classées dans la catégorie des liaisons fortes :
- la liaison covalente : liaison peptidiqueliaison peptidique, liaison de coordinationliaison de coordination, liaison responsable de la création de moléculesmolécules de petite taille (H2, 02, etc.) ou des polymères ;
- la liaison ionique : NaCl ;
- la liaison métallique, responsable de la formation des cristaux métalliques.
Les composés peuvent aussi présenter des liaisons hybrideshybrides comme une liaison iono-covalente.
Liaisons chimiques faibles : liaison de Van der Waals…
Pour briser des liaisons chimiques faibles, il suffit d'avoir recours à des énergies de quelques dizaines de kilojoules par mole.
Sont classées dans la catégorie des liaisons faibles :
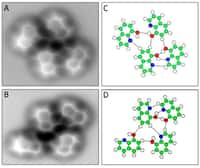
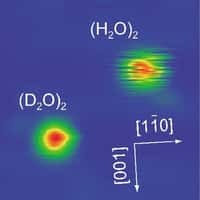
- la liaison hydrogène qui relie les molécules et implique, comme son nom l'indique, un atome d'hydrogène ; elle est responsable de nombreux paramètres de la structure de l'eau ;
- la liaison de Van der Waals, qui est à l'origine de la cristallisation des gazgaz rares à basse température et qui se retrouve, par exemple, entre deux feuillets de graphite.