au sommaire
Article paru le 26 décembre 2016
De l'eau qui passe de l'état liquideétat liquide à l'état solideétat solide à une température qui excède les 100 °C. C'est incroyable ! Et pourtant bien vrai si l'on se fie à une expérience menée par des chercheurs du MIT (Massachusetts Institute of Technology). Une expérience dans laquelle ils ont confiné de l'eau dans des nanotubes de carbone.
Comment ont-ils réussi cette prouesse ? Cela reste un mystère, reconnaissent-ils. Car les nanotubes de carbone sont réputés hydrophobes. Pourtant, des molécules d'eau sont parvenues à se frayer un chemin dans ces minuscules tuyaux à peine plus larges qu'elles. Les chercheurs du MIT ont alors fait monter la température. Et là, surprise !
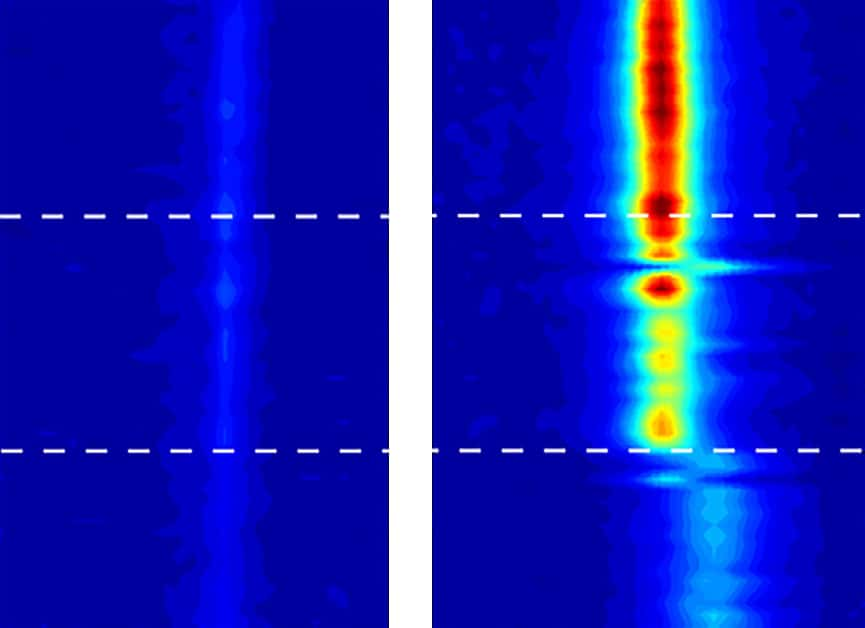
Des images en spectroscopie vibrationnelle — qui permettent de révéler les mouvements des molécules d’eau — ont trahi le comportement de l’eau confinée dans des nanotubes de carbone. À gauche, l’eau sous sa forme liquide. À droite, une eau qui commence à se solidifier au-delà de 100 °C. © Michael Strano, Massachusetts Institute of Technology
Quand l'eau gèle à 105 °C
À une température de 105 °C -- une température à laquelle en principe, l'eau devrait passer à l'état gazeuxétat gazeux --, ils ont commencé à voir apparaître des signes d'un passage de l'eau à un état solide ! Un état solide qu'ils se refusent pour l'heure d'appeler glace. Car malgré la précision de leurs mesures -- effectuées à l'aide d'un système de spectroscopie vibrationnelle -- ils n'ont pas pu en déterminer la structure cristalline particulière.
Ce qu'ils assurent en revanche, c'est qu'une infime variation du diamètre des nanotubes -- entre 1,05 et 1,06 nanomètre -- a de grandes conséquences -- plusieurs dizaines de degrés -- sur la température de solidification en question. De quoi envisager sérieusement de concevoir des câbles à eau permettant de conduire le courant protonique 10 fois plus efficacement que des câbles classiques.
L'état quantique de l'eau est aussi modifié dans un nanotube
Article de Laurent SaccoLaurent Sacco paru le 10/02/2011
Un groupe de chercheurs vient d'établir que l'état quantique des protons des molécules d'eau change lorsqu'elles se trouvent confinées dans un nanotube. Le même phénomène pourrait se produire dans les cellules vivantes.
- L'eau liquide, source de vie dans l'universunivers : un dossier à découvrir

L'eau fascine et séduit aussi bien par ses propriétés esthétiques lorsqu'elle s'écoule que par ses propriétés physiquesphysiques. Son comportement en apesanteurapesanteur, par exemple à bord de l'ISS, en est une bonne illustration. Mais la véritable raison pour laquelle de tout temps les Hommes se sont intéressés à l'eau vient certainement du fait qu'elle est une source de vie dans l'univers.
Lorsque les physiciensphysiciens ont commencé à étudier l'eau, ils ont été de surprises en surprises. Par exemple, on sait maintenant que l'eau est moins dense à l'état solide qu'à l'état liquide. Elle peut presque être considérée comme un solvantsolvant universel, tant il est facile de mettre bien des substances en solution avec elle.
La nature quantique de la liaison chimique
On a commencé à percer les secrets de l'eau à partir du moment où l'on a compris que les forces électromagnétiques intervenaient dans la nature de la liaison chimiqueliaison chimique entre atomesatomes et molécules, et surtout lorsque Schrödinger a découvert sa fameuse équation décrivant l'état quantique d'un système physique. Pour autant qu'on le sache d'ailleurs, cette équationéquation domine toute la physique et la chimiechimie, du Big Bang au Vivant, dans l'univers.
Dans l'eau liquide, des forces électrostatiquesélectrostatiques établissent des liaisons fragiles entre les atomes d'hydrogènehydrogène d'une molécule et l'atome d'oxygèneoxygène d'une autre. En utilisant des faisceaux de neutronsneutrons, un groupe de physiciens vient de découvrir que l'état quantique des protons dans les molécules d'eau n'était pas le même quand ces molécules s'ébattent librement dans un verre et quand elles se trouvent confinées dans un nanotube de carbone de 1,6 nanomètre de diamètre.
Des conséquences des cellules vivantes aux piles à combustible ?
Un changement d'état quantique a aussi été découvert dans des molécules d'eau piégées dans du Nafion. C'est une résine échangeuse d'ionsrésine échangeuse d'ions entièrement fluorée, formée d'une colonne vertébralecolonne vertébrale ne contenant que des groupes CFn sur laquelle sont branchés des groupements d'acideacide sulfonique. Le Nafion est utilisé comme catalyseurcatalyseur acide, membrane en électrosynthèse et enfin séparateur dans les piles à combustible.
Or, les distances entre les structures dans les cellules vivantes sont aussi de l'ordre de quelques nanomètres. L'eau confinée dans ces structures pourrait donc avoir des propriétés nouvelles, importantes pour la vie, inconnues jusque-là. On peut imaginer aussi que cette découverte puisse ouvrir de nouvelles pistes dans la conception piles à combustiblepiles à combustible plus efficaces.
























