au sommaire
Affinité des virus influenza A vis-à-vis de l'hôte
L'affinité du virus de la grippevirus de la grippe aviaire vis-à-vis de l'hôte est déterminée au niveau moléculaire par l'hémagglutininehémagglutinine et la neuraminidaseneuraminidase (Van and Manuguerra 2000 / 59). La restriction d'hôte fait appel à de nombreux mécanismes, et n'est pas totalement élucidée.
L'hémagglutinine
L'hémagglutinine est impliquée dans l'attachement du virus sur des récepteurs cellulaires sialyloligosaccharidiques. L'extrémité distale de chaque sous-unitésous-unité de l'HA se fixe à l'acide sialique lié à une molécule de galactose. Les virus de type A sont capables de reconnaître deux variétés d'acide sialique (SA) : l'acide N-acétylneuraminique (NeuAc) et l'acide N-glycolylneuramique (NeuGc) qui s'attachent à une molécule de galactose voisine par deux types de liaison, α2,3 ou α2,6. Chez l'homme, les organes cibles contiennent majoritairement des variétés NeuAc, à la différence des oiseaux et des porcs où l'on trouve des SA de type NeuGc. L'adaptation d'un virus à une nouvelle variété d'acide sialique requiert son échappement à des inhibiteurs sériques : sialyl-protéinesprotéines, lectines liantliant le mannosemannose, par des mutations au niveau du site de fixation à l'acide sialique de l'HA (Parrish and Kawaoka 2005 41).
La présence, à la surface des cellules hôtes, d'un récepteur sialoglycoconjugué, associant une variété de SA et un type de liaison, conditionne la spécificité de reconnaissance de ce récepteur par le virus (Suzuki, Ito et al. 2000 53).

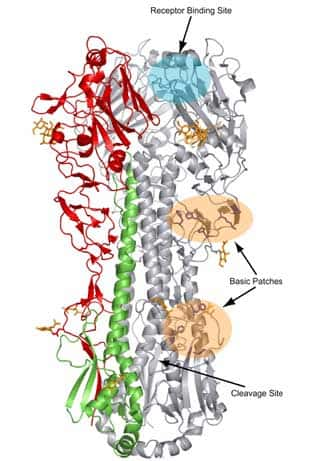
Représentation de la structure de l'hémagglutinine du virus influenza de la grippe espagnole (Receptor binding site: site de fixation au récepteur cellulaire ; Cleavage site : site de clivage). © Lisa Dunn
L'abondance d'un ou plusieurs types de récepteurs sur les cellules cibles, aux sites de réplicationréplication virale, exerce une pression de sélection variable sur la spécificité d'hôte.
Les cellules intestinales aviaires, site de réplication majeur du virus chez les oiseaux, possèdent uniquement des récepteurs cellulaires en α2,3. Les virus influenzainfluenza équins et aviaires reconnaissent SA lié au galactose (Gal) par une liaison de type α2,3 (SAα2,3Gal), ce qui explique la transmission directe des virus aviaires au cheval. Chez le porc, la présence des deux types de récepteurs au niveau de l'épithéliumépithélium trachéal explique sa sensibilité aux virus grippaux humains et aviaires.
Les récepteurs de type SAα2,6Gal sont majoritaires au niveau des cellules épithéliales respiratoires humaines. Les virus humains se lient préférentiellement à des acides sialiques attachés au Gal par des liaisons de type α2,6. Les études du tropismetropisme cellulaire des virus influenza humains démontrent que l'infection des cellules épithéliales respiratoires non ciliées est indispensable à une réplication et à une transmission efficaces du virus, les cellules non ciliées possédant majoritairement des récepteurs de type SAα2,6Gal. Les cellules ciliéescellules ciliées de l'épithélium respiratoire humain, possèdent quant à elles des récepteurs de type SAα2,3Gal qui seraient les cibles des virus aviaires, dans les cas où ils infectent l'homme (Matrosovich, Matrosovich et al. 2004 39).
La capacité de réplication des virus grippaux A est également influencée par la nature des acides aminésacides aminés en position 226 et 228 du site de fixation de l'HA au récepteur cellulaire. La présence de la glutamineglutamine en position 226 est associée à la spécificité des virus aviaires pour le récepteur SAα2,3Gal ; la leucineleucine en 226, à la spécificité des virus humains de sous-types H2 et H3 pour le récepteur SAα2,6Gal. D'autre part, l'orientation adéquate de SA au niveau du site de fixation de l'HA au récepteur cellulaire nécessite l'existence de paires d'acides aminés : ainsi, les virus humains possèdent tous la leucine en position 226 en association à la sérinesérine en position 228 ; chez les virus équins et aviaires, la glutamine en position 226 est associée à la glycineglycine en position 228 (Baigent and McCauley 2003 5).
Il est démontré qu'une simple substitution au niveau d'un des acides aminés en position 205, 226 ou 227 de l'hémagglutinine virale suffit à modifier sa spécificité de fixation à l'un des deux types de récepteurs (Suzuki 2001 51) (Suzuki 2005 52) (Gambaryan, Tuzikov et al. 2005 19). Les mutations au niveau des acides aminés en position 190 et 225 de l'HA des virus H1 humains et porcins sont associées à l'acquisition de la spécificité pour les liaisons de type SAα2,6Gal et favorisent ainsi l'adaptation des virus aviaires à l'homme et au porc (Baigent and McCauley 2003 5).
Ces mécanismes sont impliqués dans les variations de la spécificité d'hôte : la transmission des virus influenza entre différentes espècesespèces aussi bien que l'émergenceémergence de nouveaux sous-types dans la population humaine.
La neuraminidase
La neuraminidase est une sialidasesialidase responsable du clivageclivage des liaisons osidiques entre les résidus d'acide sialique et le sucresucre voisin au niveau du récepteur cellulaire à l'hémagglutinine. Son rôle dans la restriction d'hôte des virus grippaux est encore mal connu.
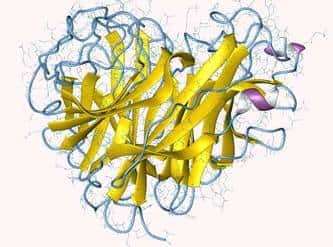
Représentation de la structure de la neuraminidase d'un virus influenza A. © Department of Biochemistry, Faculty of Medicine, University of Szeged
La spécificité de la neuraminidase pour les liaisons entre l'acide sialique et le galactose (liaisons SAα2,3Gal et SAα2,6Gal) et pour les différentes espèces moléculaires d'acide sialique (forme N-acétyl et N-glycolyl) a été étudiée chez les virus N2 : deux acides aminés en position 275 et 431 déterminent la spécificité de reconnaissance par la NA des liaisons de type SAα2,6Gal et de la forme NeuGc de l'acide sialique respectivement. La présence de la valinevaline en position 275 est associée à une haute spécificité pour les récepteurs de type α2,6, la présence de la lysinelysine en position 451 confère un haut niveau de spécificité pour l'acide sialique NeuGc. L'adaptation de la neuraminidase à différents substratssubstrats ferait appel à des substitutions d'acides aminés qui progressivement altèrent la conformationconformation de la NA au niveau et autour de son site actifsite actif, permettant ainsi la fixation des différentes espèces d'acide sialique (Kobasa, Kodihalli et al. 1999 29).
Les virus aviaires se répliquent préférentiellement dans le tube digestiftube digestif des oiseaux et sont donc adaptés à se développer dans des conditions de pH acide. Les virus humains H3N2 isolés après 1971 ne possèdent pas d'activité sialidase à pH acide. Des virus réassortants porteurs du gènegène NA humain associé aux autres gènes viraux d'origine aviaire sont incapables de provoquer une infection digestive après inoculation par voie orale (Suzuki 2005 52). L'activité enzymatiqueenzymatique de la neuraminidase des virus aviaires H1N1 est mieux conservée à pH acide que celle des virus de même sous-type adaptés à l'homme ou au porc (Baigent and McCauley 2003 5). Deux acides aminés sont impliqués dans la stabilité à pH acide de la neuraminidase des virus influenza A : l'argininearginine en position 344 et la phénylalaninephénylalanine en position 466. Des substitutions à leurs niveaux modifient l'activité enzymatique (Suzuki 2005 52). L'activité de NA à pH acide contribue à la restriction d'hôte des virus influenza A.
Les mutations au niveau du gène de la neuraminidase participent à l'adaptation des virus grippaux à de nouveaux hôtes et en conséquence au franchissement de la barrière d'espèces. L'adaptation à un nouvel hôte nécessite néanmoins une compatibilitécompatibilité entre la NA et l'HA, dans la mesure où ces protéines ont des fonctions complémentaires : la NA dissociant les liaisons entre SA et l'HA.
Les protéines internes
- Les polypeptidespolypeptides du complexe de réplication. Dans les modèles animaux et les cultures cellulaires, la protéine PB2 a une forte influence sur la spécificité d'hôte. Le résidu en position 627, même si d'autres sont impliqués, en est le déterminant majeur. Les autres polypeptides, PB1, PA et NP ont également leur rôle, et l'analyse de l'efficacité de la réplication de ribonucléoprotéines reconstituées montre que la compatibilité entre les différents polypeptides est fondamentale pour la réplication virale dans les cellules de mammifèresmammifères. La réplication est plus performante quand PB2 et NP dérivent de la même souche aviaire ou humaine, ou quand PB1 est d'origine aviaire quelle que soit sa combinaison avec d'autres gènes (Baigent and McCauley 2003 5). La combinaison de ces protéines intervient également sur le caractère thermosensible de la réplication ; les virus aviaires ont une croissance optimale à 42°C, les virus humains à 37°C (Parrish and Kawaoka 2005 41).
- Les protéines M. L'analyse des séquences d'acides aminés montre dix régions contenant des acides aminés spécifiques des souches aviaires ou humaines, le nombre de sites différents est plus important pour la protéine M2 (sept sites) que pour la protéine M1M1 (trois sites) ; on ignore actuellement lesquels d'entre eux contribuent à la restriction d'hôte. Les protéines M des virus grippaux humains ont progressivement perdu la capacité de coopérer avec l'hémagglutinine des virus aviaires, les virus réassortants sont devenus incapables de se répliquer efficacement (Baigent and McCauley 2003 5).
- Les protéines NS. Il existe deux sous-types A et B du gène NS. Tous les gènes NS des virus qui infectent les mammifères sont du sous-type A (sauf pour un virus H3N8 d'origine aviaire adapté au cheval). Il n'est pas possible cependant de différencier les isolats aviaires des isolats humains, sur la seule base de modifications d'acides aminés (Baigent and McCauley 2003 5).