au sommaire
Discussion
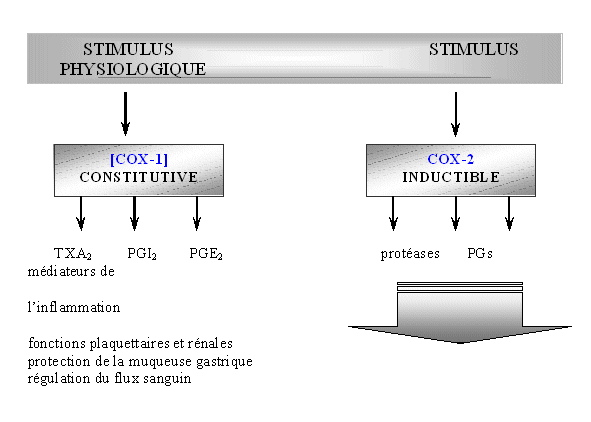
Nous avons vu en introduction que la COX-2 est largement impliquée dans de nombreux processus liés à l'inflammationinflammation cellulaire, au contraire de la COX-1 qui est responsable de la production de prostanoïdes ayant un rôle cytoprotecteur. Les recherches actuelles sur ce sujet ont conduit à la conception d'inhibiteurs spécifiques de la COX-2 par rapport à la COX-1.
Plusieurs études permettent de justifier ces recherches et leurs résultats. Chez le rat, l'emploi d'un inhibiteur spécifique de la COX-2, le célécoxib, permet de diminuer un œdèmeœdème induit par la carrageenine et il a également des propriétés analgésiquesanalgésiques, tandis qu'il n'a aucun effet sur la production des prostanoïdes au niveau de l'estomacestomac (Seibert K. et al., 1994).
Au contraire, l'emploi d'un inhibiteur de la COX-1, le SC-560, entraîne une diminution de la production du TxB2 et du PGE2 par la COX-1 au niveau plaquettaire, gastrique et dermique, mais n'inhibe pas la synthèse des prostanoïdes par la COX-2 lorsque cette enzyme est induite par le LPSLPS, et provoque alors une réponse inflammatoire (Smith C.J. et al., 1998).
Ceci permet de confirmer le rôle actif de la COX-2 dans la propagation de l'inflammation cellulaire.
Depuis longtemps, les effets secondaires des AINS comme l'aspirineaspirine ont été attribués à une inhibitioninhibition inopportune de la COX-1. Pour diminuer les effets néfastes des AINS, il est indispensable de développer des molécules qui soient capables d'agir sur l'activité enzymatiqueenzymatique de la COX-2 sans influer celle de la COX-1; dans le but de tester ces composés originaux, il faut mettre en place des modèles d'étude. Le problème qui se pose alors est la grande diversité des modèles existants (Riendeau D. et al., 1997) avec comme inconvénient majeur la grande diversité de matériels et de conditions d'expérimentation mises en œuvre (Katori M. et Majima M., 2000).
Les tests utilisant les enzymes purifiées à partir de cellules transfectées ou non transformées ne considèrent pas les problèmes existants par rapport au passage de la membrane plasmiquemembrane plasmique par des molécules (Grossman C.J. et al., 1995, Meade S.A. et al., 1993, Mitchell J.A. et al.,1993).
D'autres tests utilisent des cellules modifiées pour exprimer COX-1 ou COX-2. Dans ces cas, ce sont les caractères liés aux voies de transductiontransduction des signaux cellulaires qui peuvent être affectés et donc ne pas être pris en compte (Barnett J. et al., 1994, Laneuville O. et al., 1994).
Les expérimentations faites chez l'animal montrent également une très grande variabilité des conditions expérimentales mais aussi dans les résultats obtenus et dans les conclusions qui peuvent en être tirées (Wallace J.L. et al., 1998, Wallace J.L., 1999, Murata T. et al., 1997).
Notre but étant de tester des molécules originales, il nous fallait être sûr de la validité de notre modèle, pour cela nous avons repris et vérifié que tous les éléments, avec lesquels nous allions travailler, n'interagissaient pas entre eux. Cela commence par définir le choix des cellules et les conditions optimales afin d'obtenir les COX-1 et COX-2 dans les meilleures dispositions possibles, tout en utilisant le même type cellulaire afin de pouvoir comparer les résultats futurs de façon fiable.
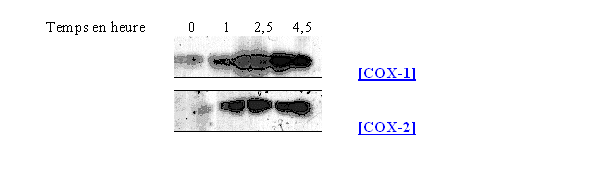
Il a tout d'abord été nécessaire de vérifier que les cellules sanguines que nous pensions utiliser par la suite étaient compatibles avec notre étude. En effet, il a fallu nous assurer qu'elles étaient capables de produire la COX-2 en quantité suffisante et constante en fonction des conditions pratiquées. Dans cet objectif, nous avons testé comme matériel cellulaire les granulocytesgranulocytes neutrophilesneutrophiles, une suspension composée de lymphocyteslymphocytes et de monocytesmonocytes et enfin un modèle utilisant le sang total. Les expérimentations mises en œuvre se sont faites avec différents temps d'incubation et avec des concentrations variables en activateur : le LPS et le PMAPMA pour induire la synthèse de COX-2 ou le calcium ionophore pour optimiser l'activité de la COX-1. Une incubation des lymphocytes et des monocytes avec le LPS à 8µg/ml pendant 3 heures suffit pour atteindre la quantité maximale de COX-2 sans que cela ait une influence notable sur la présence de la COX-1 qui est toujours présente puisque constitutive. En comparant ces résultats avec l'incubation des granulocytes neutrophiles, nous pouvons conclure que ces dernières cellules ont une capacité moindre à synthétiser la COX-2, la COX-1 étant elle aussi présente dans des proportions plus faibles, ceci confirme donc les données publiées par d'autres équipes de recherche (Harada Y. et al., 1996).
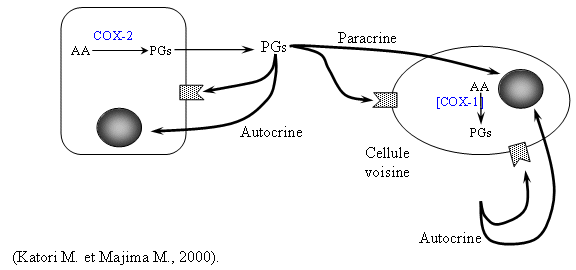
Dans les expériences mettant en œuvre le sang total, nous avons pu montrer que les quantités de COX-1 et COX-2 étaient équivalentes à celles observées dans le cas des lymphocytes et des monocytes. Toutefois, l'utilisation du sang total pose deux problèmes : le premier est une possible liaison des inhibiteurs potentiels aux protéinesprotéines plasmatiques qui seront encore présentes dans la suspension, masquant par là même le pouvoir inhibiteur de ces composés; le deuxième est que les plaquettes puissent intervenir dans la transcriptiontranscription et la traduction de la COX-1 et de la COX-2. Or, notre but est de séparer les deux modes d'activation pour être sûr de n'être en présence que de la COX-1 ou que de la COX-2, ces constituants sanguins sont donc des éléments parasitesparasites potentiels qu'il nous faut éliminer. Le meilleur choix cellulaire que nous pouvons faire est donc de prendre une suspension composée de lymphocytes et de monocytes en faisant varier les conditions d'incubation des cellules.
En ce qui concerne les activateurs, le PMA s'est montré un activateur de la COX-2 efficace, confirmant en cela d'autres travaux publiés (Crofford L.J. et al., 1994) mais dont les résultats étaient assez fluctuants et qui pouvait interagir avec les résultats de la COX-1 lorsque l'on active la COX-2, il a donc été écarté des produits à utiliser. Le calcium ionophore n'induit une activation de la transcription et de la traduction de la COX-2 que très tardivement, or ce stimulant est en principe prévu pour améliorer l'activité de la COX-1 et le temps d'incubation est inférieur à celui nécessaire à détecter la présence de la COX-2. Donc, dans nos conditions d'incubation, le calcium ionophore n'a pas d'influence sur la présence et l'activité de la COX-2.
Il existe un autre activateur qui aurait pu être testé, c'est l'interleukineinterleukine 1β (Maloney C.G. et al., 1998).
Il a été démontré qu'une activation de l'expression de la COX-2 pouvait être inhibée par la présence de l'IL-4 ou de l'IFNγ, alors qu'une activation par le LPS n'est pas influencée par ces cytokinescytokines (Barrios-Rodiles M. et Chadee K., 1998).
Il a été reporté que l'IL-4 était capable de supprimer la production des métalloprotéases, ceci est une conséquence de la diminution de la synthèse de PGE2 dans les monocytes. Si de la PGE2 est ajoutée au milieu, la synthèse de la COX-2 est à nouveau activée par une diminution de l'effet inhibiteur de l'IL-4 à ce niveau, ceci met en évidence une boucle positive d'activation de la COX-2 par ses propres produits (Mertz P.M. et al., 1996).
Dans le cas d'une utilisation du LPS comme activateur de l'expression de la COX-2, les lymphocytes et les monocytes sont moins sensibles à une inhibition par les cytokines car les voies de transduction mises en jeu sont multiples (Dworski R. et Sheller J.R., 1997).
C'est pour cela que nous avons privilégié l'utilisation du LPS par rapport à l'IL-1β.
A ce stade de la mise au point, les lymphocytes et les monocytes sont incubés avec le LPS à la concentration de 8µg/ml pendant 3 heures pour induire l'expression de la COX-2, ou avec le calcium ionophore à la concentration de 50µM pendant 1 heure dans le cas d'une étude sur la COX-1.
Dans le but de confirmer que la synthèse de la COX-2 se faisait dans des conditions normalesconditions normales pour la cellule, nous avons cherché à inhiber cette expression par un glucocorticoïde (Patrignani P. et al., 1994).
Ces composés sont connus pour bloquer la transcription de la COX-2. Nous avons constaté que la COX-2 n'était plus détectable par le western blotwestern blot lorsque les cellules ont été préalablement incubées avec la dexaméthasone, ce qui montre un effet inhibiteur de ce médicament vis à vis de la synthèse de COX-2. Nous avons également constaté que la quantité de COX-1 observée ne variait pas malgré la présence de l'inhibiteur. Ces résultats correspondent aux données connues sur les glucocorticoïdes.
En effet, il est établi que ces composés interagissent avec les récepteurs cytosoliques et altèrent la synthèse des protéines. De plus, ils sont capables d'inhiber spécifiquement un certain nombre de protéines impliquées dans la libération de l'acide arachidonique nécessaire à la synthèse des prostanoïdes par les cyclooxygénases.
Ceci leur confère une efficacité au niveau de la lutte contre l'inflammation non négligeable, mais les effets secondaires (désordres au niveau du système immunitairesystème immunitaire) engendrés sont importants, limitant alors leur utilisation dans les traitements (Kuehl F.A. et Egan R.W., 1980).
Pour notre étude, ceci montre que l'expression de la COX-2 est normalement inhibée par les glucocorticoïdes et que les cellules restent capables de répondre dans des conditions les plus proches possibles de celles rencontrées au niveau physiologique.
Nous avons vu en introduction que la PKC est une des enzymes intervenant dans l'activation de l'expression de la COX-2. Nous avons été curieux de savoir si les inhibiteurs étudiés en première partie étaient capables d'agir comme un corticoïdecorticoïde et d'inhiber la transcription de la COX-2. Pour cela, nous avons incubé les lymphocytes et les monocytes avec le chlorure de chélérythrine, et nous avons regardé s'il avait une influence sur la synthèse de COX-2 aux concentrations employées pour inhiber la PKC. Nous nous sommes aperçus que la COX-2 était présente dans des quantités équivalentes à celles observées habituellement, ce qui montre que malgré l'inhibition de la PKC, l'expression de la COX-2 est toujours présente, donc la cellule doit utiliser d'autres voies de transduction pour faire parvenir l'information jusqu'au noyau. Ce résultat concorde avec d'autres travaux publiés montrant que l'expression de la COX-2 peut être induite par différentes enzymes comme les MAP kinaseskinases (Rizzo M.T. et al., 1995), par l'intermédiaire des protéines p24 et p44.
Toutefois, il semblerait que les inhibiteurs de la PKC soient capables d'agir sur cette voie (Hipskind R.A. et al., 1994).
Par contre, ces composés n'interagissent pas avec la p38 kinase et la protéine JNK, elles aussi impliquées dans l'induction de l'expression de la COX-2 (Barry O.P. et al., 1999). A la vue de ces résultats et de ces remarques, il nous a semblé inopportun de continuer à chercher un moyen d'inhiber l'expression de la COX-2, ainsi pour limiter la production de prostanoïdes par cette enzyme conduisant à l'inflammation cellulaire, il nous faudra donc diminuer son activité enzymatique.
Pour que les cyclooxygénases soient dans les meilleures conditions possibles dans le but de produire les prostanoïdes, il faut que les enzymes puissent disposer de leur substratsubstrat à tout moment. Nous avons donc décidé d'ajouter de l'acide arachidonique au milieu afin que ce substrat ne soit pas en concentration limitante. Toutefois, un certain de nombre de précautions s'imposent car certains travaux ont montré que cet élément pouvait induire l'expression de la COX-2 (Brown Z. et al. , 1990, Puignero V. et Queralt J., 1997).
Pour prendre en compte cette hypothèse, nous avons incubé les cellules avec des concentrations variables en acide arachidonique. Nous avons pu mettre en évidence une activation de la transcription et de la traduction de la COX-2 pour des concentrations supérieures à 20µM. Ce qui confirme les données connues à ce jour sur l'action de l'acide arachidonique sur l'expression de la COX-2. Cette activation de la transcription et de la traduction de la COX-2 par l'acide arachidonique passe par les voies de transduction utilisant la PKC, la PIPI-3 kinase, la p38 kinase ou les MAP kinases (Barry O.P. et al., 1999).
En prenant en compte ces divers éléments, il a fallu mettre en place une stratégie afin de pouvoir mesurer des constantes d'inhibition sur COX-1 et COX-2 sans que les conditions d'incubation de l'une n'influencent l'autre des isoenzymes. L'idée de départ est que pour mesurer une CI50 sur COX-1, l'incubation se fait par le calcium ionophore 50µM en présence de l'acide arachidonique 50µM pendant 1 heure, ainsi la COX-2 est absente du milieu réactionnel. Dans le cas d'une mesure sur la COX-2, les lymphocytes et les monocytes sont tout d'abord incubés avec l'acide acétylsalicylique afin de bloquer le site actifsite actif de la COX-1 par acétylationacétylation de la Ser 529 et sur l'Arg 120, puis les cellules sont lavées pour éliminer l'aspirine présent, ensuite elles sont activées par le LPS 8µg/ml en présence de l'acide arachidonique 50µM pendant 3 heures. De cette façon, les prostanoïdes produits ne le sont que par la COX-2 puisque la COX-1 est bloquée de manière définitive. Le métabolitemétabolite des cyclooxygénases mesuré sera le thromboxane B2 du fait de sa large production.
Pour tenter de bloquer la COX-1, nous avons essayé deux composés : l'acide acétylsalicylique et l'acide salicylique qui est son métabolite présent dans l'organisme. Seul le premier des deux s'est montré capable de bloquer de façon définitive la COX-1. En utilisant cette stratégie nous avons pu mettre en évidence une production différenciée du TxB2 par la COX-1 ou par la COX-2, ce qui nous permettra par la suite de mesurer des constantes d'inhibition pour des produits connus ou originaux pour chacune des enzymes étudiées.
Notre modèle a de nombreux avantages. Comme nous ne travaillons pas avec du sang total, les protéines plasmatiques ne peuvent pas interférer avec les mesures faites par la suite. Les études d'inhibition se faisant sur des cellules entières et non pas sur des enzymes isolées, nous tenons compte des problèmes des passages membranaires, ce qui nous rapproche des conditions physiologiques d'utilisation des composés testés. Les lymphocytes et les monocytes sont extraits de sang, de ce fait les cellules ne sont pas modifiées, ce qui nous permet de tenir compte des différentes voies de transduction existantes et donc de travailler dans des conditions biologiques proches de la réalité. Un dernier point positif est la prise en compte de l'influence des plaquettes sanguinesplaquettes sanguines (Battistini B. et al., 1994).
Dans le cas de la mesure d'inhibition de la COX-1, ces constituants sanguins sont encore présents dans le milieu d'incubation, permettant une plus grande quantité de COX-1, car cette isoforme est largement importée par les plaquettes; toutefois nous avons prouvé que le mode d'incubation pratiqué dans ce cas n'était pas suffisant pour induire l'expression de la COX-2 ; c'est donc uniquement l'activité enzymatique de la COX-1 qui est calculée. Pour l'étude de l'inhibition de la COX-2, les cellules sont incubées par l'acide acétylsalicylique avant d'être lavées pour éliminer ce composé, ces lavages ont également l'avantage d'éliminer les plaquettes sanguines qui pourraient contaminer le milieu d'incubation; donc au moment d'activer les lymphocytes et les monocytes, la COX-1 présente est bloquée de façon irréversible et le milieu est incapable de produire d'autres COX-1 en l'absence de plaquettes sanguines, donc le TxB2 produit ne l'est que par la COX-2.
La dernière partie de la mise au point du modèle est l'utilisation de molécules dont les CI50 sont connues, afin de vérifier que les valeurs obtenues sont cohérentes avec celles publiées. Nous avons choisi l'aspirine et l'ibuprofèneibuprofène comme AINS non spécifiques de la COX-2 par rapport à la COX-1, le nimésulide comme inhibiteur préférentiel de la COX-2. Dans le cas des inhibiteurs non spécifiques de la COX-2 nous avons pu calculer des ratios de sélectivité CI50 COX-2/CI50 COX-1 de 7,16 pour l'aspirine et de 3,10 pour l'ibuprofène. Ces valeurs sont conformes avec celles connues puisque les chiffres habituellement sont compris entre 1 et 10 (Riendeau D. et al., 1997, Vane J.R. et Botting R.M., 1998).
Dans ce premier cas, notre modèle est capable de mettre en évidence des composés qui sont plutôt sélectifs de la COX-1 par rapport à la COX-2, de plus les valeurs d'inhibition sont conformes à celles attendues.
En ce qui concerne le nimésulide, le ratio de sélectivité est de 0,01. Les valeurs régulièrement communiquées sont comprises entre 0,01 et 0,0004 (Riendeau D. et al., 1997, Grossman C.J. et al., 1995). Nous obtenons donc des valeurs qui sont en accord avec celles connues dans le cas d'une molécule qui est un inhibiteur sélectif de la COX-2 par rapport à la COX-1.
A la lecture des résultats précédents, notre modèle est donc utilisable pour tester des molécules inhibitrices potentielles des cyclooxygénases et nous serons en mesure de déterminer des CI50, ainsi que les ratios CI50 COX-2/CI50 COX-1 de sélectivité correspondants. A partir des valeurs calculées, et en fonction des variations des ratios de sélectivité nous pourrons donner quelques indications quant aux parties de la structure chimique indispensables pour avoir des produits les plus sélectifs possibles.
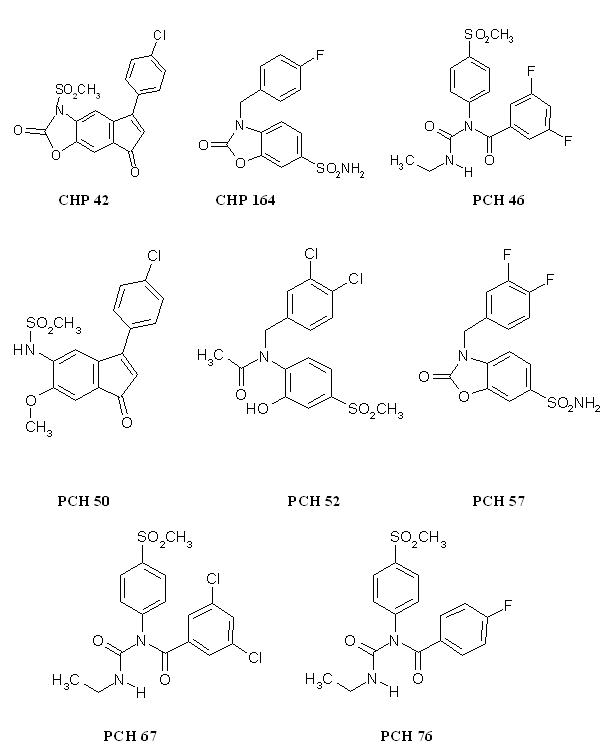
Sur ce modèle, nous avons testé 8 molécules originales (annexe 3) ayant été synthétisées à l'Institut de ChimieChimie Pharmaceutique Albert Lespagnol par l'équipe du professeur Daniel Lesieur. La principale difficulté que nous avons rencontrée lors de ces tests concerne la faible solubilité des composés, ce qui explique que pour un certain nombre de produits nous n'ayons pas été capables de déterminer une CI50 pour la COX-1 (CHP 42, le CHP 164 et le PCH 57). Néanmoins, certaines molécules se sont avérées comme bons inhibiteurs de la COX-2, il s'agit du PCH 76, du PCH 46, du PCH 50 et du PCH 52. D'autres se sont révélées comme mauvais inhibiteurs de la COX-1, en l'occurrence le PCH 46, le PCH 57 et le CHP 164. Enfin, et c'est ce qui nous intéresse le plus, certains produits sont de bons inhibiteurs sélectifs de la COX-2 par rapport à la COX-1 (PCH 46, le PCH 50, le PCH 52 et le PCH 57). Nous allons maintenant discuter les résultats obtenus en essayant d'établir quelles sont les parties des molécules qui sont des éléments importants pour inhiber de façon sélective la cyclooxygénase-2 par rapport à la cyclooxygénase-1.
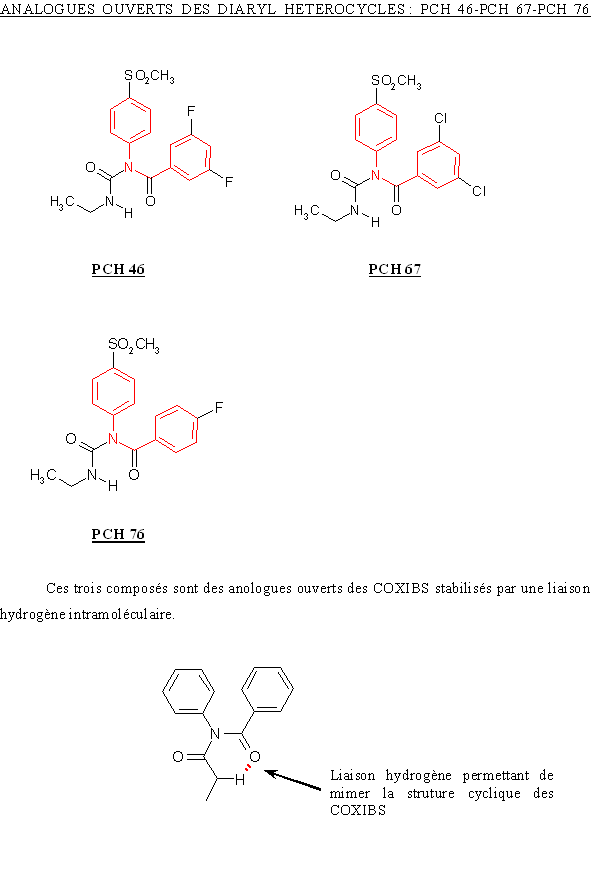
Les molécules testées n'appartenant pas à une famille homogène, il est difficile de les comparer toutes entre elles. Toutefois, pour celles dont les structures découlent d'un même squelette, nous allons voir comment il est possible d'interpréter les résultats obtenus. Ces composés sont classés en trois catégories : les dérivés des diaryl hétérocycles avec les analogues ouverts et les analogues partiellement ouverts et enfin les dérivés des méthane sulfonanilides.

Ces trois molécules ne sont différentes que par les substitutions présentes sur le phényle. Le PCH 76 (CI50 COX-2= 0,27 µM) substitué par un atomeatome de fluorfluor en position para est un meilleur inhibiteur de COX-2 par rapport au PCH 46 (CI50 COX-2= 0,56 µM) qui lui est subtitué par deux atomes de fluor positionnés en position méta.
En ce qui concerne une comparaison vis à vis de la COX-1, il nous est impossible de commenter les résultats car la valeur de CI50 pour le PCH 46 est extrapoleé de la courbe et elle est donc sujette à discussion, par la même nous ne pouvons tirer de conclusion valide en ce qui concerne une éventuelle augmentation ou diminution de sélectivité pour la COX-2 par rapport à la COX-1.
Le PCH 67 (CI50 COX-2= 6,7 µM) est substitué en position méta par deux atomes de chlorechlore, ce qui diminue sa capacité à inhibier la COX-2 par rapport au PCH 76. Les valeurs de CI50 pour la COX-1 sont également en faveur du PCH 76, en effet, elle est de 4,16 µM pour le PCH 76 et de 18 µM pour le PCH 67. Mais, en calculant le ratio CI50 COX-2/CI50 COX-1, il est possible de constater que le PCH 76 est pus sélectif pour la COX-2 par rapport à la COX-1 que le PCH 67.
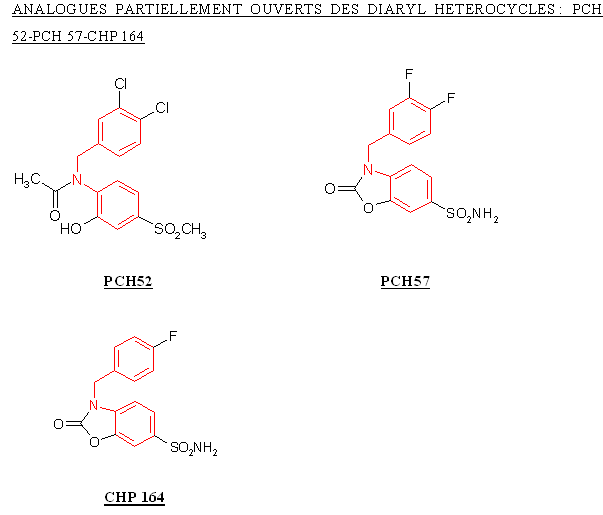
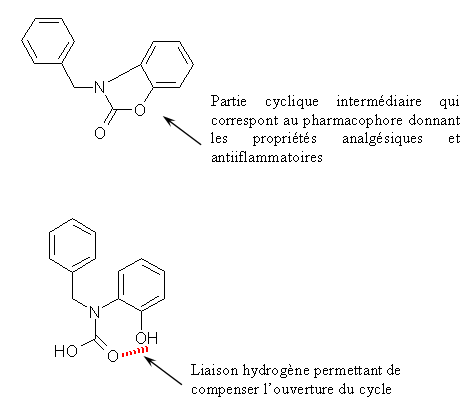
Le CHP 164 et le PCH 57 sont des analogues des diaryl hétérocycliques possédant un cycle sur la partie intermédiaire, ce cycle correspondant au pharmacophore donnant les propriétés analgésiques et antiinflammatoires de ces composés. Le PCH 52 possède une structure voisine mais le cycle est ouvert et le composés est stabilisé par une liaison hydrogèneliaison hydrogène.
La structure du PCH 52 étant trop éloignée de celle du CHP 164 et du PCH 57, nous ne pouvons identifier les changements qui ont contribué à influencer l'inhibition de la COX-2 ou la sélectivité.
Le CHP 164 possède un atome de fluor en position para, le PCH 57 possède deux atomes de fluor situés en méta et en para, ce qui entraine une augmentation de l'inhibition de la COX-2, puisque la valeur de CI 50 passe de 5,7 µM à 2,5 µM. Nous ne pouvons conclure quant à la sélectivité, car les valeurs de CI 50 pour COX-1 n'ont pu être établies par manque de solubilité des composés testés.
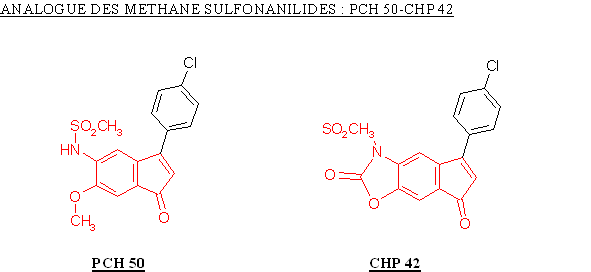
Le PCH 50 a été obtenu par ouverture de cycle à partir du CHP 42, ceci a entrainé une augmentation du potentiel de la molécule à inhiber la COX-2 avec une valeur de CI 50 qui passe de 0,96 µM à 0,37 µM. Nous ne pouvons juger de l'influence de cette modification sur la sélectivité car la valeur de CI 50 pour la COX-1 n'a pu être déterminée.