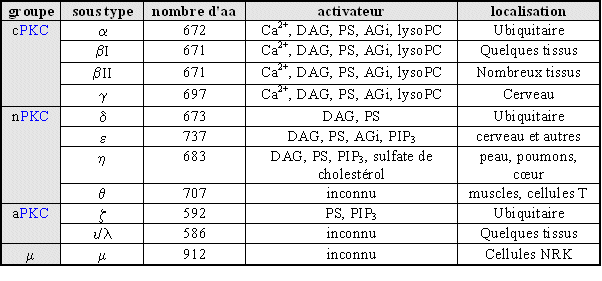
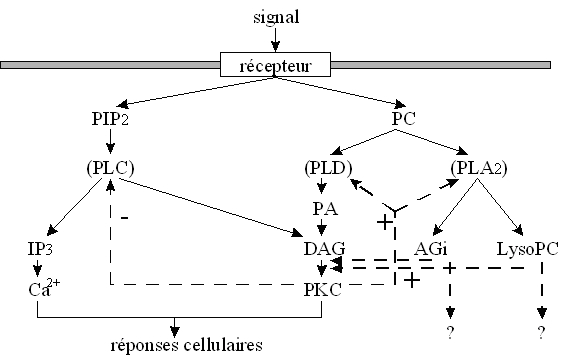
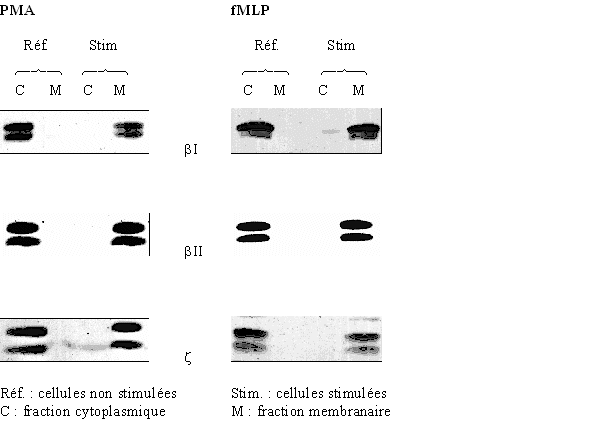
au sommaire
La PKC dans la flambée respiratoire chez le granulocyte neutrophile
L'un des sujets de recherche du laboratoire est l'inflammationinflammation cellulaire. La décision a été prise d'étudier le rôle de la PKC dans la production des radicaux libresradicaux libres de l'oxygène lors de la flambée respiratoire et les moyens de l'enrayer. Pour cela, un modèle d'étude de cette enzyme permettant de tester des molécules potentiellement inhibitrices a été mis au point.
1.4.1. LA FLAMBEE RESPIRATOIRE
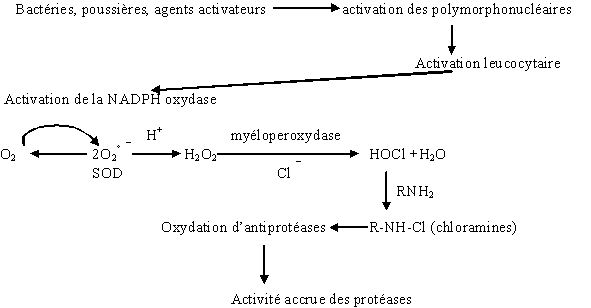
La présence de bactériesbactéries, de poussières ou plus généralement d'agents activateurs stimulent les macrophagesmacrophages qui libèrent des facteurs chimiotactiques, provoquant une activation leucocytaire et ainsi un afflux de polynucléairespolynucléaires neutrophilesneutrophiles. Par une série de stimulationsstimulations successives, la protéineprotéine kinasekinase C peut phosphoryler la NADPH oxydase qui est alors activée entraînant la flambée respiratoire (fig. 18) (Roos D., 1991).

fig. 18 : Mécanismes permettant l'induction de la flambée respiratoire.
Cette flambée respiratoire conduit à la formation d'anions superoxydes suivie de la production d'autres espèces chimiquesespèces chimiques. L'ensemble de ces produits fait partie des espèces réactives de l'oxygène ou ERO (Mc Phail L.C. et al., 1995, Heyworth P.G. et al., 1991).
Tous ces événements ont lieu lors de la phagocytosephagocytose.
1.4.2. L'ACTIVATION DE LA NADPH OXYDASE
La NADPH oxydase se présente sous la forme d'un complexe enzymatiqueenzymatique qui est localisé au niveau de la membrane plasmiquemembrane plasmique. Elle est constituée d'une flavocytochrome b qui est un hétérodimère formé par une sous unité de 91 kDa (gp91-phox) et d'une sous unité de 22 kDa (p22-phox).
Pour que l'activité enzymatique puisse exister, deux autres protéines cytoplasmiques interviennent : la p47-phox et la p67-phox. Dans des cellules non stimulées, ces protéines sont localisées dans le cytosolcytosol ; lors de l'activation, elles sont transloquées vers la membrane plasmique où elles s'associent avec gp91-phox et p22-phox (Deleo F.R. et Quinn M.T., 1996).
Au cours de cette activation, les protéines Rac et Rap1a jouent un rôle sur la régulation de la NADPH oxydase. La liaison entre Rap1a et la NADPH oxydase est favorisée losqu'un GTPGTP est fixé sur la première des deux protéines (fig. 19). Plus récemment, il est apparu qu'un autre constituant de la NADPH oxydase, la p40-phox, peut être spécifiquement phosphorylée, et donc activée, par la [protéine kinase C]. Le rôle précis de la p40-phox dans l'activité enzymatique de la NADPH oxydase n'est pas encore éclairci (Someya A. et al., 1999).
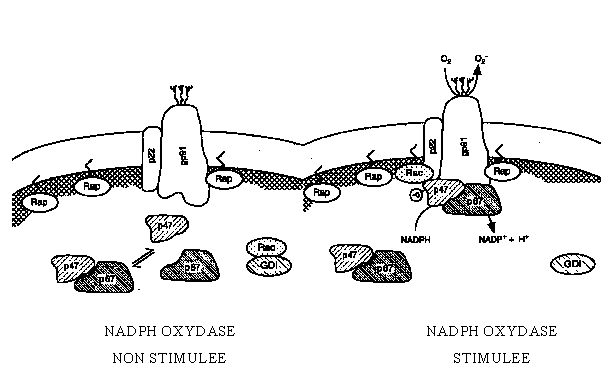
fig. 19 : Schéma d'activation de la NADPH oxydase (Deleo F.R. et Quinn M.T., 1996).
Dans ce processus d'inflammation, la [protéine kinase C] joue un rôle dans l'activation de la NADPH oxydase. Dans un premier temps, la PKC phosphoryle les sous unités p47-phox et p67-phox, permettant ainsi leur translocationtranslocation vers les composantes membranaires de la NADPH oxydase. Dans un second temps, d'autres phosphorylationsphosphorylations peuvent alors avoir lieu afin que la NADPH acquiert sa compétence catalytique (Quinn M.T., 1995).
1.4.3. LA FORMATION DES ESPECES REACTIVES DE L'OXYGENE
Lors de l'activation du granulocyte neutrophile, l'oxygène O2 est transformé en anion superoxyde Osub>2 par la NADPH oxydase. Cet ionion subit l'action de la superoxyde dismutase (SOD) pour donner le peroxyde d'hydrogèneperoxyde d'hydrogène H2O2. Il est ensuite dissocié en radical hydroxyleradical hydroxyle OH et en ion hydroxyde OH- par la réaction de Fenton en oxydant l'ion ferreux Fe2+ en ion ferrique Fe3+. Le peroxyde d'hydrogène peut également être transformé en hypochlorite HOCl grâce à la myéloperoxydase (MPO) libérée par les granules azurophiles du granulocyte neutrophile (Fontecave M. et Pierre J.L., 1991).
Cet hypochlorite peut réagir avec une amine primaire RNH2 pour former une chloramine RNHCl qui est un inhibiteur d'antiprotéasesantiprotéases, permettant ainsi l'action des protéasesprotéases correspondantes (fig. 20). La défense de l'organisme contre des facteurs exogènesexogènes est assurée, entre autre, par ces protéases et par les différentes espèces réactives de l'oxygène.
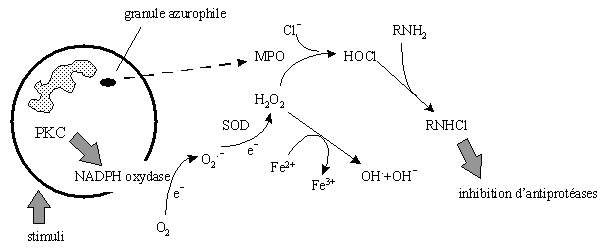
fig. 20 : Formation des espèces réactives de l'oxygène.
Dans les cas où ces mécanismes ont lieu de façon prolongée, cela peut induire des effets toxiques, notamment en dégradant les cellules et les tissus environnants, qu'il faut alors chercher à atténuer, ce qui montre l'intérêt de cette étude.
Les radicaux libres de l'oxygène peuvent provoquer plusieurs types de lésions. Une altération des structures lipidiques par la lipoperoxydation essentiellement des acides grasacides gras, des acides aminésacides aminés entraîne des modifications de structure et de propriété des protéines, des acides nucléiquesacides nucléiques favorisant des perturbations dans la transcriptiontranscription et dans la réplicationréplication lorsque les systèmes de réparation sont débordés, modifications également au niveau des sucressucres impliquant des changements dans les glycoprotéinesglycoprotéines et des altérations de l'ADNADN lorsque les désoxyribosesdésoxyriboses sont touchés.