au sommaire
Généralités sur la protéine Kinase C
La protéineprotéine kinasekinase C] est une sérinesérine /thréoninethréonine kinase, ce qui signifie qu'elle est capable de phosphoryler d'autres protéines sur les fonctions alcools de ces résidus d'acides aminésacides aminés, lorsqu'ils sont compris dans une séquence dite consensus. Elle est considérée comme un médiateur classique de nombreux agonistesagonistes extracellulaires qui produisent divers seconds messagers lipidiques (Kishimoto A. et al., 1980). La [protéine kinase C] est de ce fait impliquée dans différentes fonctions physiologiques de la cellule comme les phénomènes d'apoptoseapoptose, l'activation des plaquettesplaquettes, la conformation de l'actineactine dans le cytosquelettecytosquelette, la modulationmodulation de l'activité des canaux ioniquescanaux ioniques, la sécrétionsécrétion et la prolifération cellulaire ( Toker A., 1998).
De façon plus générale les kinases et les phosphatases sont associées pour réguler et coordonner différents aspects métaboliques. Ces contrôles se font par phosphorylationphosphorylation et déphosphorylation de protéines effectrices. Le nombre de domaines protéiques ayant une activité kinasique est proche de 400 (Hardie G., Hanks S., 1995). Le séquençageséquençage de ces domaines ainsi que des études menées en cristallographiecristallographie ont permis de montrer qu'ils possèdent des structures similaires ; la seule différence notable concerne le site de reconnaissance du substrat qui est variable donnant ainsi la spécificité de chaque enzyme. Les autres variations existantes entre les protéines kinases se localisent en dehors de ces domaines kinasiques ; elles consistent, la plupart du temps, en une addition de domaines ou de sous-unitéssous-unités ayant un rôle dans la régulation de l'enzyme.
Il est à noter que la régulation de ces différentes kinases montre également peu de variations. Les régulations possibles sont au nombre de cinq : la première est faite par ajout d'un domaine ou d'une sous-unité en réponse à un second messager (AMP cyclique se liantliant au domaine régulateur de la protéine kinase AMP cyclique dépendante PKA), la deuxième peut être une liaison à une sous unité dont le niveau d'expression varie avec l'état physiologique de la cellule (régulation des protéines kinases cyclinecycline-dépendante par la cycline), la troisième se fait par reconnaissance d'un domaine en fonction de la localisation subcellulaire de l'enzyme (liaison des domaines SH2 et SH3 aux Src kinases), la quatrième se fait par addition d'un domaine qui inhibe l'activité enzymatiqueenzymatique par un processus de rétrocontrôle (cas de la kinase à chaîne légère de myosine), la dernière méthode de régulation se fait par phosphorylation ou déphosphorylation de résidus d'acides aminés localisés sur des segments particuliers de la kinase (cas de la kinase calmoduline dépendante II) (Johnson L.N. et al., 1996).
La famille des protéines kinases C est hétérogène et regroupe les kinases phospholipidesphospholipides dépendantes. Les différentes isoenzymes sont constituées d'une seule chaîne protéique composée de régions conservées (C1 à C4) et de régions variables (V1 à V5).
Chaque protéine est constituée de deux domaines. Le premier a une fonction de régulation ; il est situé du côté N-terminal avec une masse moléculaire allant de 20 à 40 kDa environ et réagit à différents activateurs en fonction de l'isoforme concernée. Le deuxième est le domaine catalytique situé du côté C-terminal avec une masse moléculaire proche de 45 kDa. C'est à ce niveau que vient se fixer le nucléotidenucléotide donneur de phosphate qu'est l'ATPATP et le substrat qui est une protéine acceptrice de phosphate. Ils sont reliés entre eux par la région V3 qui sert de charnière et qui peut subir une protéolyseprotéolyse par l'action de la calpaïne (Azzi A. et al., 1992, Newton A.C., 1997, Jaken S., 1996).
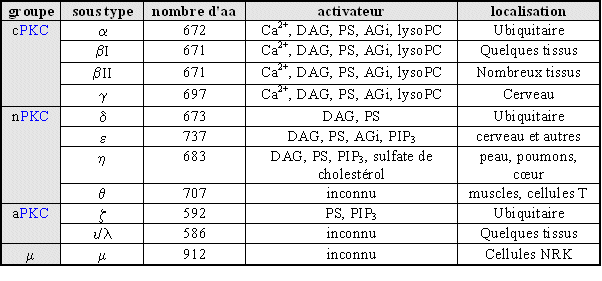
Les 10 isoformes de la [PKC], qui seront détaillées plus loin, sont regroupées en trois catégories : classique ou conventionnelle (c[PKC]), nouvelle (n[PKC]) et atypique (a[PKC]) (Nishizuka Y., 1995, Nakamura S.I., Nishizuka Y., 1994).
A ces premières isoenzymes, il convient d'ajouter les kinases rattachées aux protéines kinases C comme l'isoforme µ, plus récemment découverte et donc peu connue, et qui n'est pas encore définitivement classée (Johannes F.J. et al., 1994), ainsi que les PRKs pour [PKC]-related kinases (Palmer R.H. et al., 1995, Mellor H., Parker P.J., 1998).
Ces isoformes sont différenciées par leur expression tissulaire, leur localisation et les facteurs capables de les activer (fig. 1). Toutefois, il est à remarquer que les mécanismes d'activation semblent similaires pour l'ensemble des isoenzymes malgré des activateurs différents.
![fig.1 : Isoformes de la [PKC] dans les tissus de mammifères fig.1 : Isoformes de la [PKC] dans les tissus de mammifères](https://cdn.futura-sciences.com/cdn-cgi/image/width=1024,quality=60,format=auto/sources/images/dossier/rte/816_siomboing1.gif)
fig.1 : Isoformes de la [PKC] dans les tissus de mammifères
1.2.1. STRUCTURE PRIMAIRE
D'apparence similaire, les structures primaires des différentes isoformes de la [protéine kinase C] présentent pourtant d'importantes variations sur le domaine régulateur (fig.2) (Jaken S., 1996).
Il y a peu d'informations qui existent sur la structure du domaine catalytique, mais il semblerait qu'il soit bien conservé d'une kinase à une autre malgré une assez forte diversité dans les substrats potentiels (Kazanietz MG. et al., 1993).
![fig.2 : La famille des protéines kinases C et protéines rattachées aux [PKC] fig.2 : La famille des protéines kinases C et protéines rattachées aux [PKC]](https://cdn.futura-sciences.com/cdn-cgi/image/width=1024,quality=60,format=auto/sources/images/dossier/rte/816_siomboing2.gif)
fig.2 : La famille des protéines kinases C et protéines rattachées aux [PKC]
1.2.1.1. Domaine régulateur
C'est sur ce domaine que viennent se fixer les activateurs, le calcium et les cofacteurs. Cette partie de la protéine est également impliquée dans les phénomènes de reconnaissances et de liaisons protéine-protéine, l'ensemble de ces éléments permettant de contrôler l'activité et la localisation de l'enzyme dans la cellule.
Toutes les isoenzymes possèdent la région C1. C'est le lieu de fixation du diacylglycérol, de ses analogues fonctionnels et des estersesters de phorbol. La liaison avec ces esters se fait dans une cavité par des interactions hydrophobeshydrophobes, la reconnaissance de ces composés chimiques se fait grâce à une séquence présente sur chaque région riche en cystéinecystéine : HX12CX2CX13/14CX2CX4HX2CX7C où X indique un acide aminé quelconque (Quest A.F. et al., 1992, Quest A.F. et al., 1994).
Il a été remarqué, par des études de cristallographie, que leurs liaisons ne produisent pas de changement conformationnelchangement conformationnel significatif de la protéine. Pourtant, la liaison aux estersliaison aux esters de phorbol permet une modification de la surface hydrophobe de cette région C1, autorisant une liaison avec la cible membranaire au cours de la translocationtranslocation de l'enzyme du cytoplasmecytoplasme vers la membrane plasmiquemembrane plasmique permettant son activation (fig. 3 ; 5 et 6).
La liaison au diacylglycérol permet de stabiliser la conformation active de l'enzyme. Le domaine C1 est classé en typique ou atypique selon qu'il fixe ou non les esters de phorbol (Wilkinson S.E., Nixon J.S., 1998).
Il existe d'autres domaines C1 dans d'autres enzymes (Raf-1 kinase par exemple), mais ces protéines ne sont pas capables de lier les esters de phorbol. En comparant les structures primaires des domaines, on remarque l'absence, dans le second cas, des résidus d'acides aminés nécessaires à la formation de la poche hydrophobe, et donc au site de liaison (Toker A., 1998.).
![fig. 3 : Hypothèse sur le mode d'activation des [PKC] par les esters de phorbol fig. 3 : Hypothèse sur le mode d'activation des [PKC] par les esters de phorbol](https://cdn.futura-sciences.com/cdn-cgi/image/width=1024,quality=60,format=auto/sources/images/dossier/rte/816_siomboing3.gif)
fig. 3 : Hypothèse sur le mode d'activation des [PKC] par les esters de phorbol
Cette région possède également une zone riche en cystéine qui forme deux structures globulairesglobulaires appelées structure en doigt de zinczinc qui sont capables de coordonner 2 ionsions de zinc (Zn2+), le groupe atypique ne possède qu'une seule structure. Ces cationscations permettent de maintenir la conformation tridimensionnelle de la protéine. Par ailleurs, cette structure étant très proche de celle des protéines capables de se lier à l'ADNADN, il n'est pas impossible que la [protéine kinase C] puisse également avoir une activité de liaison sur l'ADN (Liu W.S., Heckman C.A., 1997).
Sur cette région C1 vient se greffer une séquence pseudosubstrat composée d'une vingtaine d'acides aminés, qui permet l'autoinhibition de la [protéine kinase C] lorsqu'elle est sous sa forme inactive (fig. 3 et 4). L'enchaînement des acides aminés composant cette région ressemble à une séquence consensus susceptible de subir une phosphorylation par de la [PKC], mais la sérine ou la thréonine est remplacée par une alaninealanine. De ce fait aucune phosphorylation ne peut avoir lieu sur ce peptide qui joue alors un rôle d'autoinhibition (Nishizuka K. et al., 1997).
L'isoforme µ possède les domaines en doigt de zinc mais ils sont séparés par 74 acides aminés, ce qui expliquerait une faible aptitude à lier les esters de phorbol. De plus, cette protéine ne possède pas de région pseudosubstrat.
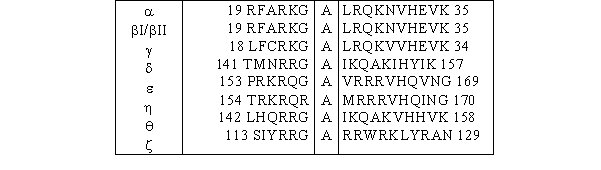
fig. 4 : Séquences pseudosubstrat
L'activation de la protéine kinase C nécessite la translocation de l'enzyme du cytoplasme vers la membrane plasmique où le diacylglycérol peut se lier à la région C1. Par ailleurs, il existe également une région C2 possédant une affinité pour les ions calcium. La liaison de ces cations sur ce deuxième domaine provoque un changement de conformation de la protéine. La conjugaison de ces deux modifications permet d'obtenir une enzyme ayant une compétence catalytique et de stabiliser cette conformation active (Newton A.C., 1995).
La région C2 (fig. 7, fig. 8), présente sur les isoformes classiques, contient une structure en β-turn, formant une poche où peut se fixer le calcium. Cet ion métallique se coordonne avec des résidus d'acides aspartiquesacides aspartiques.
Des études, menées en résonance magnétique nucléairerésonance magnétique nucléaire et en cristallographie, ont permis de mettre en évidence la conjugaison de cette poche avec deux ions. Ces interactions provoquent un changement de conformation exposant ainsi, sur la face antérieure du domaine, trois résidus de lysinelysine, qui peuvent alors se coupler avec des acides lipidiques. Ceci permet un couplage à la membrane plasmique avec toutefois une faible affinité.
Sur les isoformes nouvelles, il est à noter la présence d'une région C2 modifiée, notamment par l'absence des résidus d'acides aspartiques nécessaires pour le couplage avec les ions calcium, cette différence empêchant leur fixation. Certains lipideslipides pourraient se fixer sur cette région C2 modifiée et permettraient l'obtention d'une conformation accessible pour la membrane plasmique (Wilkinson S.E., Nixon J.S., 1998). Les isoformes atypiques ne possèdent pas de région C2.
![fig. 5 : [PKC] δ avec deux esters de phorbol (Zhang G. et al., 1995) fig. 5 : [PKC] δ avec deux esters de phorbol (Zhang G. et al., 1995)](https://cdn.futura-sciences.com/cdn-cgi/image/width=1024,quality=60,format=auto/sources/images/dossier/rte/816_siomboing5.gif)
fig. 5 : [PKC] δ avec deux esters de phorbol (Zhang G. et al., 1995)
![fig. 6 : [PKC] γ avec deux esters de phorbol (Xu R.X. et al., 1997) fig. 6 : [PKC] γ avec deux esters de phorbol (Xu R.X. et al., 1997)](https://cdn.futura-sciences.com/cdn-cgi/image/width=1024,quality=60,format=auto/sources/images/dossier/rte/816_siomboing6.gif)
fig. 6 : [PKC] γ avec deux esters de phorbol (Xu R.X. et al., 1997)
![fig. 7 : domaine C2 de la [PKC] (Pappa H. et al., 1998) fig. 7 : domaine C2 de la [PKC] (Pappa H. et al., 1998)](https://cdn.futura-sciences.com/cdn-cgi/image/width=1024,quality=60,format=auto/sources/images/dossier/rte/816_siomboing7.gif)
fig. 7 : domaine C2 de la [PKC] (Pappa H. et al., 1998)
![fig. 8 : [PKC] β couplée avec un ion calcium et un phospholipide (Sutton R.B. et al., 1998) fig. 8 : [PKC] β couplée avec un ion calcium et un phospholipide (Sutton R.B. et al., 1998)](https://cdn.futura-sciences.com/cdn-cgi/image/width=1024,quality=60,format=auto/sources/images/dossier/rte/816_siomboing8.gif)
fig. 8 : [PKC] β couplée avec un ion calcium et un phospholipide (Sutton R.B. et al., 1998)
1.2.1.2. Domaine catalytique
Le domaine catalytique a une structure présentant de fortes homologieshomologies d'une isoforme à l'autre, voire avec d'autres kinases. La principale différence se situe au niveau de la reconnaissance de la séquence consensus à phosphoryler se trouvant sur le domaine C4. Le site de reconnaissance permet d'établir des contacts électrostatiquesélectrostatiques sur des surfaces acides. La spécificité de la [PKC] peut être modulée selon sa localisation subcellulaire par des interactions protéine-protéine (Aderem A. A. et al., 1998).
![fig. 9 : Schéma de l'isoforme α de la [protéine kinase C] fig. 9 : Schéma de l'isoforme α de la [protéine kinase C]](https://cdn.futura-sciences.com/cdn-cgi/image/width=1024,quality=60,format=auto/sources/images/dossier/rte/816_siomboing9.gif)
fig. 9 : Schéma de l'isoforme α de la [protéine kinase C]
Pour l'activité catalytique, l'ATP se fixe sur la région C3 et le substrat sur la région C4. L'enzyme est alors capable de transférer le phosphate en γ de l'ATP sur une sérine ou une thréonine de la protéine à phosphoryler (fig.9).
Sur le domaine catalytique de l'isoforme α, il a été décrit une séquence qui permettrait une translocation de l'enzyme du cytoplasme vers la membrane nucléaire. Cette translocation est liée à certains types cellulaires et gérée par des mécanismes de translocation particuliers (Neri L.M. et al., 1994).
Il est possible, in vivoin vivo, de cliver la [PKC] au niveau de la région V3 par la calpaïne I ou II. Ceci permet d'obtenir le domaine régulateur seul ; dans ce cas on peut remarquer une activité enzymatique qui devient constitutive et capable de jouer un rôle dans les fonctions cellulaires impliquant la [protéine kinase C]. Il est à noter que la spécificité de substrat peut varier par rapport à l'enzyme native (Orr J.W., Newton A.C., 1994).
Le nombre de protéines substrats de la [protéine kinase C] décrit est très élevé, ce qui confirmerait un manque de sélectivité de l'enzyme.
Toutefois, des peptidespeptides synthétiques ont été utilisés avec la séquence consensus suivante : RXXS/TXRX, où X indique un acide aminé quelconque.
La présence de résidus basiques de part et d'autre des résidus sérine ou thréonine favorisent la phosphorylation du substrat (Nishizuka K. et al., 1997), et plus précisément aux positions -6, -4 et -2. De légères différences ont été néanmoins observées : les [PKC] classiques préfèrent des résidus basiques aux positions +2, +3 et +4, tandis que les [PKC] atypiques privilégient des résidus hydrophobes à ces positions ; l'isoforme µ montre une forte spécificité pour une leucineleucine en position -5 (Nishizuka K. et al., 1997).
Quelques cas de sélectivité ont pu être montrés. La protéine MARCKS (myristoylated alanine-rich C-kinase substrate) est un substrat ubiquitaire de la [PKC] dans toutes les cellules, or elle est phosphorylable par toutes les isoformes à l'exception de la [PKC] ζ (Uberall F. et al., 1997).
Inversement, une protéine, la plekstrin (platelet and leukocyte C-kinase substrate protein), substrat de la [PKC] et se trouvant uniquement dans les cellules d'origine hématopoïétique peut être phosphorylée par toutes les isoformes de cette enzyme (Brumell J.H. et al., 1997).
La ribonucléoprotéine A1 est phosphorylée efficacement par la [PKC] ζ mais pas par les autres isoenzymes (Municio M. et al., 1995). Malgré ces différences, il est clair que la spécificité du substrat est faible suggérant ainsi d'autres mécanismes pour expliquer une activité discriminante de la [PKC]. Ceci passe par une localisation intracellulaire et des activateurs variables. Un autre élément permet d'explorer la spécificité des mécanismes d'activation, c'est l'existence de protéines d'ancrage à la [PKC] : RACKs (receptors for activated C-kinase) (Mochly Rosen D. et al., 1991).
La [protéine kinase C], dans sa conformation activée, peut se lier à ces protéines d'ancrage lui permettant ainsi d'atteindre le substrat approprié. D'autres protéines d'ancrage sont connues : ZIPZIP (zeta-interacting protein) spécifique du domaine régulateur de l'isoforme ζ (Puls A. et al ., 1997) ou LIP (lambda-interacting protein) liée à l'isoforme λ (Diaz Meco M.T. et al., 1996).
1.2.2. CLASSIFICATION
Comme il a déjà été dit auparavant, la [protéine kinase C] est séparée en trois groupes : classique, nouvelle et atypique. Le classement de l'isoforme µ n'est pas encore clairement déterminé et pourrait donner naissance à une quatrième catégorie de [protéine kinase C] de par une structure primaire montrant des différences significatives avec celle décrite pour les autres isoformes (Nishizuka Y., 1995, Nakamura S.I., Nishizuka Y., 1994).
D'autres kinases, dont les caractéristiques ne sont pas encore très bien établies, donnent naissance à une nouvelle classe de protéines qui sont appelées kinases rattachées aux [PKC] dites PRK (Mellor H., Parker P.J., 1998).
1.2.2.1. Groupe des [PKC] classiques
Il rassemble les isoformes α, βI, βII et γ. Seul ce groupe possède la région C2 permettant une activation par le calcium (Stabel S., Parker P.J., 1991). Cette activation peut se faire également par le diacylglycérol, les esters de phorbol et la phosphatidylsérine. L'activation par les phospholipides est calcium dépendante et elle est nécessaire pour la translocation de l'enzyme vers la membrane plasmique.
Ces isoformes sont présentes de façon ubiquitaire dans la plupart des tissus. La [PKC] γ est davantage trouvée dans le système nerveux centralsystème nerveux central et dans la moelle épinièremoelle épinière. Les lymphocyteslymphocytes T possèdent un taux plus élevé en isoformes α et β (Nishizuka Y., 1998). Les isoformes βI et βII sont issues du même gènegène, c'est l'arrangement variable de ce gène lors de la transcriptiontranscription qui conduit à la synthèse de deux protéines différentes.
1.2.2.2. Groupe des [PKC] nouvelles
Il regroupe les isoformes δ, ε, η et θ. Il est à noter la présence d'une région C2 modifiée ne permettant pas une activation par le calcium. De façon générale, la stimulationstimulation se fait par le diacylglycérol, les esters de phorbol et nécessite la phosphatidylsérine comme cofacteur.
L'isoforme ε peut-être activée par les acides grasacides gras cis insaturés, par le phosphatidylinositol-3,4,5-triphosphate et dans une moindre mesure par le phosphatidylinositol-4,5-diphosphate.
Elle existe sous une forme phosphorylée mais le rôle de cette phosphorylation n'est pas encore entièrement élucidé. Elle est très largement distribuée dans l'organisme, sa concentration est plus élevée dans les cellules hépatiques et dans les terminaisons présynaptiques au niveau du système nerveux central.
L'isoforme δ est activée par les acides gras cis insaturés en l'absence de diacylglycérol. La stimulation peut également se faire par le phosphatidylinositol-3,4,5-triphosphate et par le phosphatidylinositol-4,5-diphosphate. Cette isoforme existe sous une forme phosphorylée, probablement due à c-Src ou c-Fyn, sur une tyrosinetyrosine ; cette modification ne semblerait pas influencer l'activité enzymatique. Cette isoforme est également ubiquitaire, mais elle est trouvée en plus grande quantité dans les cellules nerveuses.
L'isoforme η peut être stimulée par le phosphatidylinositol-3,4,5-triphosphate, le phosphatidylinositol-4,5-diphosphate et par le sulfate de cholestérolcholestérol. On la trouve principalement dans les cellules de la peau, des poumonspoumons, de la raterate et du cerveaucerveau.
L'isoforme θ peut être activée par la phosphatidylsérine. Elle est prédominante dans les cellules des muscles squelettiquesmuscles squelettiques et à un niveau moindre dans les poumons, la rate, la peau et le cerveau (Hug H., Sarre T.F., 1993).
1.2.2.3. Groupe des [PKC] atypiques
Il regroupe les isoformes ζ, ι (λ chez la souris). Elles ne possèdent pas de région C2 mais il est à remarquer la présence d'une unique structure en doigt de zinc.
Pour une activité maximale, le diacylglycérol n'est pas nécessaire. Elles sont activées par la phosphatidylsérine avec addition d'un ligandligand inconnu, par contre elles sont insensibles au calcium, certainement à cause de l'absence de la région C2. Les protéines kinases C ζ et λ apparaissent comme pouvant être activées, plus fréquemment que d'autres, par l'intermédiaire de récepteurs à tyrosine kinase (Nishizuka Y., 1995).
L'isoforme ζ peut être stimulée par les acides gras cis insaturés, le phosphatidylinositol-3, 4, 5-triphosphate et le phosphatidylinositol-4, 5-diphosphate. Cette isoforme possède sur son extrémité N-terminale un site de liaison pour les esters de phorbol et la phosphatidyl sérine avec toutefois une affinité plus faible que pour les autres isoformes liant ces moléculesmolécules (Kazanietz M.G. et al., 1994.). Certaines études montrent que cette isoforme est ubiquitaire. Cette isoforme peut se localiser au niveau des noyaux de fibroblastesfibroblastes et participer à la synthèse de l'ADN, ceci serait la conséquence d'une activation par la protéine Ras (Berra E. et al., 1993).
L'isoforme λ a été isolée de cellules sécrétant de l'insulineinsuline et des cellules de carcinomescarcinomes. Elle présente des séquences d'acides aminés très proches de l'isoforme ζ.
Les signaux entraînant leurs activations ne sont pas encore connus. Une surexpression de ces isoformes implique une activation transcriptionnelle d'éléments cis en réponse au sérumsérum ou à divers facteurs de transcription (Hug H., Sarre T.F., 1993).
1.2.2.4. Isoforme µ
Cette isoforme a tout d'abord été classée dans le groupe des isoformes nouvelles à cause de sa structure primaire, les différences observées dans un premier temps le sont au niveau du domaine régulateur mais aussi sur la sélectivité des substrats (Johannes F.J. et al., 1994).
En effet, elle contient deux régions riches en cystéine C1 capables de se lier aux esters de phorbol et au DAG, mais elle a sur son extrémité N-terminale une séquence qui est potentiellement transmembranaire et qui n'est pas présente chez les autres isoformes (Valverde A.M. et al., 1994).
Cette isoforme a une homologue chez la souris: la protéine kinase D, qui forme une classe distincte dans la famille des kinases (Van Lint J.V. et al., 1995). Elles ont, toutes les deux, de fortes similitudes avec les kinases calmodulines dépendantes et il n'y a pas encore de régions pseudosubstrats qui ont été identifiées.
Elle est sensible à la phosphatidylsérine et au diacylglycérol. Un domaine PH (pleckstin homology) lui confère la possibilité de se lier aux phosphoinositides et aux lipides (Iglesias T., Rozengurt E., 1998).
Il se pourrait également que des interactions protéine- protéine existent grâce à ces domaines mais aussi des interactions entre 2 domaines PH, ceci permettrait la transmission de signaux avec un certain niveau de spécificité ; ces domaines pourraient également servir d'inhibiteurs afin de réguler l'activité enzymatique de cette isoforme (Iglesias T., Rozengurt E., 1998).
Son activation pourrait dépendre d'autres protéines kinases C bien qu'aucune phosphorylation de la [PKC] µ par les autres enzymes n'ait pu être prouvée (Johannes F.J. et al., 1994).
Toutefois, elle pourrait servir comme protéine d'échafaudageéchafaudage pour diverses enzymes impliquées dans d'autres processus, pour cela la partie transmembranaire serait essentielle (Nishikawa K. et al., 1998).
1.2.2.5. Les kinases rattachées aux PKC
D'autres kinases présentent des homologies avec les protéines kinases C : les PRK 1, 2, 3. Le domaine catalytique est similaire à celui des autres isoenzymes, les différences se situent au niveau du domaine régulateur. Ces kinases ne possèdent pas de domaine C1 et C2, ce qui interdit une liaison avec les esters de phorbol ou les ions calcium, elles peuvent être activées par le phosphatidylinositol-4,5-diphosphate ou le phosphatidylinositol-3,4,5-triphosphate (Palmer R.H. et al ., 1995).
L'activité kinasique peut être directement régulée par de petites protéines liant le GTPprotéines liant le GTP, notamment par un site HR1 permettant la reconnaissance de protéines Rho liant le GTP (Flynn P. et al., 1998). Ce site HR1, appelé initialement Rho-binding, est composé de trois répétitions d'environ 55 acides aminés, il existe plusieurs variantes de ce motif permettant des interactions avec différents complexes GTP-RhoA sous leur forme active ou inactive (Mellor H. et al., 1998).