au sommaire
L'imagerie sur cellules vivantes apporte une meilleure compréhension des mécanismes biologiques. Depuis 1992 et le clonage du gène codant pour une protéine fluorescente naturellement présente dans certaines espècesespèces de méduseméduse, la GFP (Green Fluorescente Protein), ces techniques ont connu un développement important. La technique classique consiste à fusionner la GFP avec une protéine d'intérêt et surexprimer cette protéine fusionfusion dans les cellules. En illuminant les cellules avec une source de lumièrelumière de longueur d'ondelongueur d'onde définie, la protéine devient fluorescente et peut être suivie dans la cellule en temps réel. Cette méthode n'est pas sans problèmes techniques et impose la surexpression d'une protéine hybridehybride qui peut affecter la fonction de la protéine à étudier et être toxique pour les cellules.
Il est apparu nécessaire de développer des méthodes d'étude des proteines endogènesendogènes à la cellule. Certaines techniques utilisées jusqu'à présent utilisaient des particules de latexlatex ou des particules d'or. L'inconvénient majeur réside dans la large taille (de 40 à 500 nm) de ces particules qui risquent de perturber la fonction de la protéine ciblée. D'autre part, ces particules n'émettent pas de lumière ce qui fait que leur observation est basée sur leur pouvoir de dispersion de la lumière. Des fluorophores de petites tailles (1 à 4 nm) sont aussi utilisés, mais leur grande photosensibilité ne permet que des analyses de courte duréedurée (de l'ordre de quelques secondes).
Les nanocristaux (ou point quantique) sont assimilés à des fluorophores inorganiques. Ce sont des cristaux ayant une taille de l'ordre du nanomètrenanomètre et composés d'une centaine d'atomesatomes. Ils ont été développés dans les années 80 pour des applicationsapplications en optique et électronique. Lorsque le cristal est illuminé, il réémet de la lumière à une longueur d'onde directement dépendante de sa taille. Sa photostabilité lui permet de garder ses propriétés fluorescentes pendant une vingtaine de minutes comparé aux quelques secondes d'autres fluorophores. Les développements en biologie sont apparus lorsque les nanocristaux ont été recouverts d'une surface organique pour les rendre solubles.
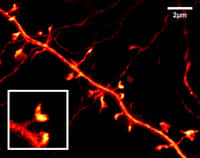
Des chercheurs de l'Ecole Normale Supérieure de Paris ont utilisé des nanocristaux recouverts de streptavidine, une moléculemolécule organique ayant une forte affinité pour la biotine, pour visualiser la dynamique du récepteur à la glycineglycine (GlyR) à la surface des neuronesneurones. Le récepteur est initialement reconnu par un anticorpsanticorps spécifique couplé à la biotine. Les cellules sont ensuite incubées avec les nanocristaux qui vont se coupler à l'anticorps, lui-même associé au récepteur. Les mouvementsmouvements sont ensuite analysés en microscopie.
Ils ont ainsi confirmé que la vitessevitesse de diffusiondiffusion des récepteurs à la glycine était différente suivant leur localisation, de type brownien (agitation moléculaire aléatoire) dans la région extrasynaptique et de plus en plus ralentie à l'approche de la synapsesynapse où le récepteur est censé interagir avec son neurotransmetteurneurotransmetteur et des protéines cytoplamiques pour permettre la transmission d'un signal. Leurs données montrent que le récepteur change de localisation en permanence et que les techniques précédentes, utilisant des particules plus grosses, ralentissaient les vitesses de diffusion du récepteur.
Outre sa petite taille, un autre avantage du nanocristalnanocristal est que, dû à sa nature cristalline, il peut être visualisé par microscopie électronique. Ainsi, une même cellule peut être observée en temps réel puis, la localisation fine de la protéine observée, déterminée par microscopie électronique. Enfin, bien que la gamme de protéines fluorescentes organiques se soit étendue ces dernières années (on peut trouver des protéines « bleues, vertes, jaunes ou rouges »), leurs spectres d'émissionspectres d'émission se chevauchent rendant la discrimination entre elles délicate dans le cadre d'observations simultanées de plusieurs protéines. Cet inconvénient peut être contourné par les nanocristaux. Leur spectre d'émission est symétrique, relativement étroit et directement dépendant de la taille du cristal. Cela permet d'envisager l'observation de multiples protéines en utilisant des nanocristaux de longueur d'onde définie et bien séparée.