au sommaire
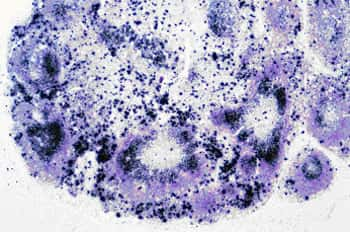
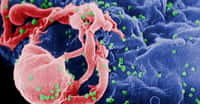
Ganglion mésentérique infecté par la souche SIVmac251, variante animale du VIH. Les taches noires représentent les cellules qui répliquent le virus. Crédit : INSERM 2007.
Mais de nombreuses interrogations persistaient sur la localisation de ce réservoir, qui permettait une réalimentation rapide d'un individu en virus actifs après l'arrêt d'un traitement, et constituait ainsi une barrière incontournable à la guérison. De plus, les capacités immunitaires de l'organisme semblaient impuissantes face à ce réservoir du VIH.
Une équipe de chercheurs dirigée par Jérôme Estaquier, de l'Unité Inserm 841 à l'Institut Mondor de Recherche Biomédicale (IMRB) de Créteil et de l'Unité CNRS de Physiopathologie des Infections Lentivirales à l'Institut Pasteur à Paris, vient d'apporter un élément de réponse décisif à la question.
En étudiant des modèles animaux, ils ont pu déterminer que ces réservoirs se situaient au niveau des ganglions lymphatiques de la région intestinale (ganglions mésentériques), le virus pouvant y rester dans le cas d'organismes infectés depuis plus de 10 ans alors qu'il est devenu indétectable ailleurs.
Mais ce n'est pas tout, car la même équipe a aussi démontré que la duréedurée de survie des lymphocytes T CD8 cytotoxiquescytotoxiques au sein de ces ganglions était considérablement réduite. Or ces "lymphocytes tueurs" sont habituellement capables de détruire les cellules infectées et d'ainsi combattre la prolifération du virus. Poussant leurs investigations plus loin, les scientifiques ont aussi détecté la présence de TGF-bêtabêta, une cytokinecytokine immunosuppressive qui pourrait être à l'origine de cette anomalieanomalie.
Le taux réduit de lymphocytes T CD8 en raison de leur courte durée de vie permet donc au VIH de se disséminer des ganglions mésentériques vers les autres organes, provoquant ainsi la progression vers le stade sidasida.
Vers une nouvelle voie de recherches
Les travaux de ces chercheurs fourniront peut-être la clé de nouvelles stratégies de lutte contre le VIH, qui passeraient par l'inhibitioninhibition des fonctions immunodépressives du TGF-bêta ou au rétablissement de la durée de vie normale des cellules T CD8 afin de permettre à l'organisme de réguler lui-même la prolifération du virus ou même de l'éradiquer. D'autres types de thérapiesthérapies sont aussi envisagés, ciblant en particulier les ganglions mésentériques.
Il est bien entendu encore trop tôt pour crier victoire car le processus d'infection par le VIH se réclame d'une très grande complexité dont tous les aspects sont loin d'être connus, mais le pas qui vient d'être franchi pourrait se révéler capital. Néanmoins, de nombreuses expérimentations in vivoin vivo ainsi que sur échantillons humains seront encore nécessaires avant de déboucher à un nouveau traitement.
Cette étude a été publiée dans la revue Cell Death and Differentiation.
Sources principales :
CNRS URA 1930; Unité de Physiopathologie des Infections Lentivirales, Institut Pasteur, Paris, France.
Unité Inserm 841, Institut Mondor de recherche Biomédicale (IMRB), Créteil, Paris, France.