au sommaire

Le cancer du sein est favorisé par des mutations de la protéine BRCA2. La purification de cette protéine, attendue depuis 15 ans, permettra certainement d'accélérer la lutte contre ce fléau. Crédits DR
Voilà quinze ans que la communauté scientifique la traque et trois laboratoires indépendants viennent de toucher au but simultanément : la protéine BRCA2 (Breast Cancer Type 2 susceptibility protein), dont beaucoup de mutations sont responsables de cancers du sein, est désormais purifiée. Cette protéine est connue depuis 1995 et son rôle est plus ou moins bien déterminé : elle serait un suppresseur de tumeur, permettant de réparer l'ADN en cas de dommage.
La purification d’une protéine permet de pouvoir l'étudier sous toutes les coutures. Elle permet de mettre la protéine en contact avec d'autres partenaires protéiques ou nucléiques pour déterminer précisément son rôle biologique. La protéine peut également être cristallisée afin d'en déterminer la structure et donc d'ouvrir des pistes pour découvrir des moléculesmolécules capables d'interagir avec elle ou d'inhiber sa fonction.
Mais la purification d'une protéine est un chemin semé d'embûches. Chaque étape peut vite devenir un problème : le clonage du gènegène, l'expression de la protéine dans des cellules (spécialement modifiées pour sécréter en grande quantité le produit du gène inséré), la séparationséparation de la protéine de tous les autres constituants de la cellule, sa solubilisation...
La réussite de la purification de BRCA2 n'était donc pas gagnée d'avance, d'autant que sa grande taille (3.418 acides aminésacides aminés) n'est pas un atout. Il s'agirait même de la première protéine aussi longue jamais purifiée. Pourtant, c'est aujourd'hui chose faite, même s'il a fallu à l'un des chercheurs quatre ans pour la seule optimisation de la purification.
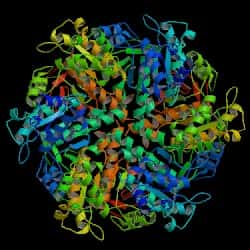
Alors que la structure de la protéine BRCA2 est en attente, celle de son partenaire, la protéine RAD51 (de la levure Saccharomyces cerevisiae), est déjà connue. © Protein Data Base
Rôle confirmé de BRCA2 dans la réparation de l’ADN
Une des trois équipes (de l'Université de Californie, Davis) a extrait la protéine à partir de cellules épithéliales de reinrein humaines. Les chercheurs de l'UC Davis Cancer Center ont, quant à eux, purifié la protéine à partir de cellules de levurelevure. La troisième équipe, basée au Cancer Research UK à Londres, a préféré utiliser des cellules épithéliales cancéreuses. Les trois équipes, qui ont respectivement publié leurs résultats dans Nature et Nature Structural & Molecular Biology, ont ajouté des « tags », c'est-à-dire des peptidespeptides fusionnés en bout de protéine pour améliorer la solubilité et le repliement de BRCA2 et donc favoriser sa stabilité.
Les études ultérieures réalisées sur la protéine purifiée ont permis de confirmer certaines de ses fonctions déjà supposées, sans grande surprise. Ainsi, BRCA2 favoriserait l'action de la recombinase nommée RAD51. Elle augmenterait la spécificité d'interaction de RAD51 avec l'ADN simple brin et stimulerait sa capacité d'échanger un fragment d'ADN endommagé par un ADN correct. Les chercheurs ont aussi montré qu'il existerait des formes monomériques et dimériques de la protéine BRCA2, d'après des observations au microscope électroniquemicroscope électronique.
La suite des expériences devrait apporter de nouvelles réponses, notamment en modifiant la séquence de la protéine à l'image des mutations observées chez des patientes puis en observant l'effet sur les propriétés de BRCA2 (en purifiant cette fois la protéine mutée). De plus, la cristallisation de la protéine afin d'obtenir sa structure est en cours, mais là encore l'optimisation peut demander beaucoup de temps.