au sommaire
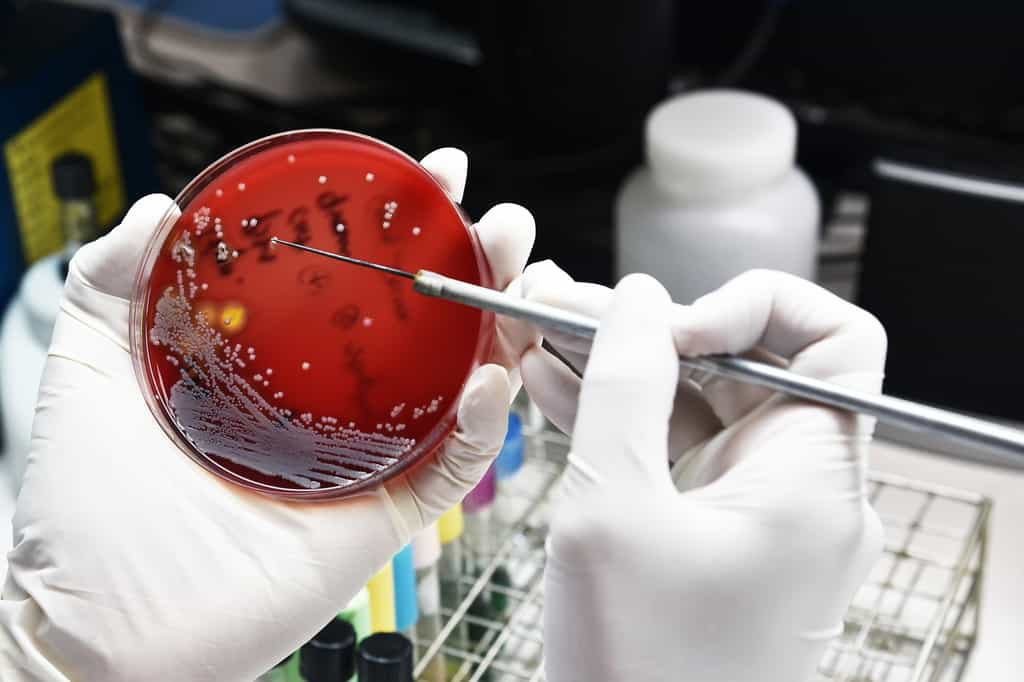
Dans le cadre des recherches portant sur l'étude des enzymesenzymes du microbiote intestinal, des chercheurs de l'Inra et de l'Inserm ont étudié la bactérie Bacillus subtilisBacillus subtilis, considérée comme un modèle. Son analyse génétique a en effet révélé la présence de gènes conservés chez des bactéries communes du microbiote intestinal, comme les entérocoques.
Les scientifiques se sont notamment intéressés à deux gènes de B. subtilis codant potentiellement pour un peptide et une enzyme appartenant à la super-famille dite des enzymes à radical SAM. Leurs travaux ont permis de décrire un nouveau mécanisme enzymatiqueenzymatique capable de transformer un peptide en une moléculemolécule bio-active. Appelée épimérisation, cette transformation enzymatique entraîne le changement de configuration de certains acides aminésacides aminés de la configuration L (configuration normale au sein des peptidespeptides) vers la configuration D, qui est en principe inactive. Les chercheurs ont découvert comment cette enzyme fonctionne. Elle arrache un atomeatome d'hydrogènehydrogène au carbonecarbone alpha (le premier) des acides aminés pour en donner un nouveau. Il s'agit d'un mécanisme inédit dans le vivant.
Des épipeptides limitent la croissance de la bactérie
C'est la première fois que des chercheurs démontrent in vitroin vitro la capacité d'enzymes à radical SAM de catalyser des épimérisations au sein d'un peptide. De manière surprenante, le peptide ainsi modifié et appelé épipeptide, est capable d'inhiber très efficacement la croissance de B. subtilis.
Ces épipeptides représentent donc une nouvelle classe de produits naturels qui pourraient servir à développer de nouveaux antibiotiques contre les bactéries à Gram positifbactéries à Gram positif (comme les staphylocoques, entérocoques ou les streptocoquesstreptocoques) dont la résistancerésistance croissante aux antibiotiquesantibiotiques représente un problème majeur de santé publique.
Ces résultats paraissent dans Nature Chemistry.
Vers une nouvelle classe d'antibiotiques ?
Article de Claire Peltier, paru le 10/08/2010
Une nouvelle classe d'antibiotiques vient peut-être d'être découverte suite à l'obtention de la structure tridimensionnelle d'une enzyme bactérienne essentielle et d'une molécule inhibitrice.
Depuis leur découverte en 1928 par Alexander Fleming, les antibiotiques ont révolutionné la médecine en sauvant de nombreuses vies. Leur utilisation massive et, surtout, parfois excessive rend progressivement les bactéries résistantes et l'on risque de se retrouver sans défense face aux futures épidémiesépidémies. La recherche de nouveaux antibiotiques est un défi pour les médecins, qui n'ont pour l'instant dans leurs mains qu'un nombre limité de molécules efficaces pour lutter contre les infections bactériennes. Bien que de nouveaux antibiotiques arrivent parfois sur le marché, ces événements sont encore trop rares.
Une classe d'antibiotiques particuliers, les quinolonesquinolones, sont connues et utilisées en médecine depuis près de cinquante ans. Elles ont pour caractéristique d'inhiber spécifiquement et efficacement la protéineprotéine topoisomérasetopoisomérase IIA des bactéries. Cette enzyme, aussi appelée gyrase, a pour rôle de modifier l'enroulement de l'ADNADN au sein de la bactérie, un processus essentiel lors de la multiplication cellulaire ou lors de l'expression des gènes. Pourtant, les bactéries supportent de plus en plus cette classe d'antibiotiques et deviennent donc difficiles à éliminer.
Aujourd'hui, des cristallographes du laboratoire GlaxoSmithKline ont réussi à cristalliser puis à déterminer la structure, grâce aux rayons Xrayons X, de la gyrase de la bactérie Staphylococcus aureusStaphylococcus aureus, ou staphylocoque doré. Mais l'enzyme n'est pas seule sur l'image : l'ADN et une nouvelle molécule nommée GSK 299423 sont co-cristallisés avec l'enzyme. La technique permet de visualiser précisément la position de chaque atome, avec ici une incertitude de 2,1 angströms, autant dire pas grand-chose. La structure de l'interaction entre les trois partenaires est donc très bien résolue et offre des informations capitales, révélées dans la revue Nature.
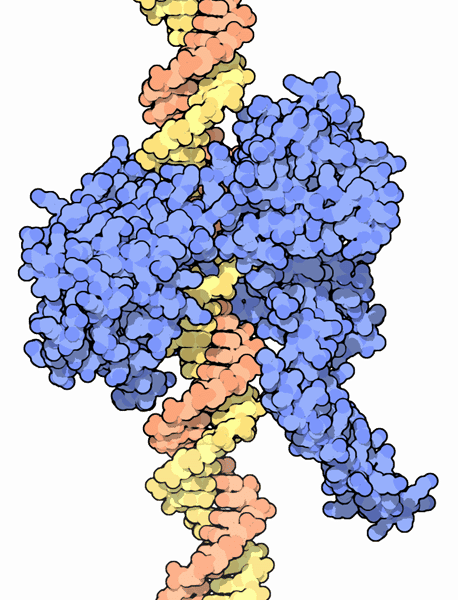
La topoisomérase (bleu) permet d'enrouler ou de dérouler les molécules d'ADN (orange et jaune) lors de la réplication ou de l'expression des gènes. L'enzyme est essentielle à la survie des bactéries. Crédits DR
Efficace sur un large spectre de bactéries
Les scientifiques ont constaté que la molécule GSK 299423 construit un pont moléculaire entre l'ADN et une zone de la gyrase étrangère au site actifsite actif de l'enzyme. La molécule n'agit donc pas au niveau du site actif, comme le font les quinolones. Ainsi, la résistance adoptée par certaines bactéries contre les quinolones, pourrait être contournée par l'usage de cette nouvelle molécule. Puisque la même enzyme est ciblée, les mêmes bactéries devraient être éliminées par GSK 299423.
En effet, l'efficacité de cette molécule a été testée sur un large spectrespectre de bactéries et elle semble efficace, à l'image des quinolones, sur les deux grandes classes existantes : aussi bien les Gram-positives (positives au colorant de Gram) à l'image de Staphylococus aureus (même la souche résistante à la méticilline impliquée dans beaucoup d'infections nosocomialesinfections nosocomiales), que les Gram-négatives (négatives au colorant de Gram) comme Escherichia coliEscherichia coli, PseudomonasPseudomonas, Klebsiella ou Acinetobacter, qui sont plus difficiles à éliminer à cause de la présence d'une membrane externe souvent imperméable aux molécules.
Cette molécule semble donc constituer un bon candidat pour la recherche de nouveaux antibiotiques. Le laboratoire GlaxoSmithKline s'intéresse à toutes les molécules de la même famille afin de déterminer laquelle serait la plus à même d'être utilisée en médecine. Il faut à la fois tenir compte de l'efficacité antibactérienne, mais aussi de l'innocuité pour les patients. La structure obtenue permet d'orienter les chercheurs dans cette voie. Les financements de cette étude sont d'ores et déjà prolongés pour une duréedurée de 5 ans par le Wellcome Trust's Seeding Drug Discovery, une initiative du Defense Threat Reduction Agency américain.
Inserm
--------------
Présentation de l'Inserm
Créé en 1964, l’Institut national de la santé et de la recherche médicale (Inserm) est un établissement public à caractère scientifique et technologique, placé sous la double tutelle du Ministère de l’Éducation nationale, de l’enseignement supérieur et de la recherche et du ministère des Affaires sociales, de la santé et des droits des femmes. Ses chercheurs ont pour vocation l’étude de toutes les maladies, des plus fréquentes aux plus rares, à travers leurs travaux de recherches biologiques, médicales et en santé des populations. L’ensemble des équipes regroupe près de 15 000 chercheurs, ingénieurs, techniciens, gestionnaires, hospitalo-universitaires, post-doctorants…