au sommaire
Alzheimer, Parkinson, scléroses, diabète de type 2... Les scientifiques estiment qu'environ 300 maladies sont dues à des protéines qui ne se replient pas comme il faudrait, ce qui change leur structure tridimensionnelle et les rend inefficaces. C'est pourtant le rôle des protéines chaperonnes de veiller à la bonne maturation, et donc à la bonne conformation spatiale, des peptides cellulaires.
Mais dans le vivant, tout ne fonctionne pas toujours comme il le faudrait. Il arrive que des protéines, déformées, n'assurent plus leur fonction, entraînant de nombreuses conséquences sur tous les processus dans lesquels elles jouaient un rôle fondamental. Parfois aussi, elles s'agrègent et forment des amas néfastes, comme les béta-amyloïdes à l'origine des plaques séniles dans la maladie d'Alzheimer.
La recherche s'organise et des chercheurs de la Northwestern University de New York viennent de publier deux études différentes qui ouvrent des pistes pour contrer cette mauvaise conformation des protéines. Chacune de ces études leur a valu trois ans de travail. « Des robotsrobots ont dû être utilisés d'une part pour alléger le fardeau de ce travail prévu à très grande échelle, mais aussi pour fournir une meilleure précision » nous confie Richard Morimoto, dernier auteur de l'étude.
Dix-neuf mille gènes éteints un à un
La première, publiée dans Plos Genetics, a été réalisée sur le ver Caenorhabditis elegansCaenorhabditis elegans, très souvent utilisé car il partage avec nous de nombreux mécanismes biologiques et l'on connaît l'intégralité de son génome.
Les chercheurs américains ont testé les 19.000 gènes du nématodenématode en les éteignant un à un pour voir lesquels pouvaient préserver les cellules de l'agrégation protéique et des peptides défectueux. Ils ont pu montrer qu'environ 150 fractions chromosomiques étaient impliquées. Un nombre considérable.
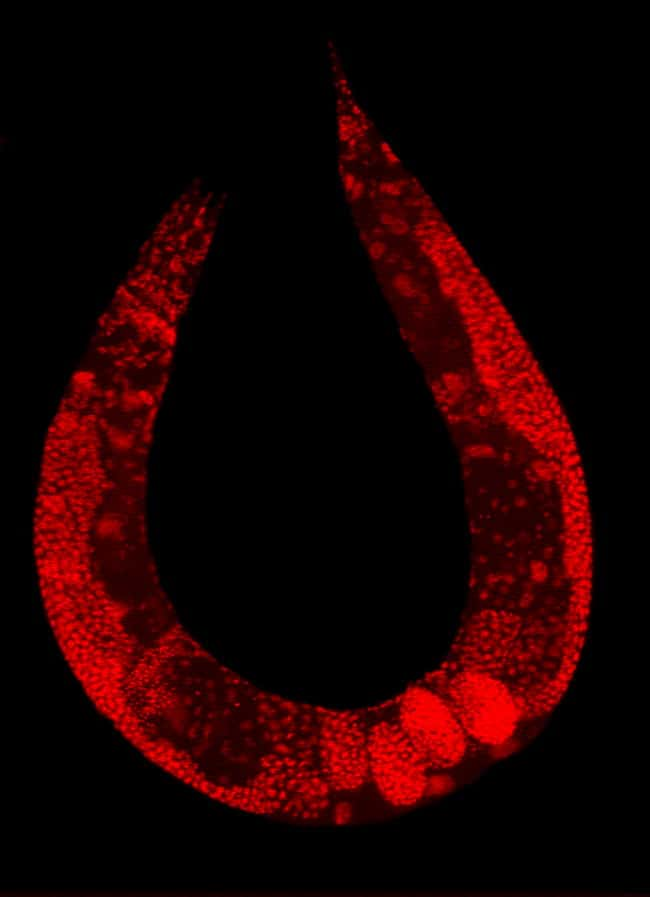
Le ver C. elegans est souvent utilisé au laboratoire, notamment pour tenter de comprendre le développement embryonnaire ou le vieillissement cellulaire. © Plos
En poursuivant plus loin leurs investigations, 9 gènes sont sortis du lot. Ils forment ensemble un réseau qui préserve la bonne santé des cellules. Parmi eux, cinq induisent la synthèse de protéines chaperonnes. Richard Morimoto remarque que « se focaliser sur l'action de 9 gènes plutôt que sur 150 rend la tâche beaucoup plus abordable ».
Près d’un million de candidats, une trentaine de reçus
L'étude parue dans Nature Chemical Biology relève encore de la minutie et de la patience des chercheurs new-yorkais. Cette fois, ce sont environ 900.000 moléculesmolécules passées au crible avec le même objectif : voir lesquelles préservent la bonne santé des cellules, en les testant in vitroin vitro sur du tissu humain.
L'étude a révélé 7 classes de composants, rangés selon leur structure moléculaire, qui favorisent la synthèse de protéines chaperonnes efficaces. Ces molécules ont été appelées « régulateurs de protéostasie », un néologisme se référant à l'homéostasie (homogénéité d'un système biologique) du protéomeprotéome (l'ensemble des protéines).
Si tous les mécanismes ne sont pas bien clarifiés, ils ont constaté que ces composés particuliers réduisent l'agrégation protéique et empêchent la mauvaise conformation spatiale des protéines.
Parmi tous ces régulateurs de protéostasie, les auteurs se sont attardés sur une trentaine de molécules, plus ou moins actives, parmi lesquelles certaines pourraient prétendre à devenir un jour de sérieuses candidates à l'élaboration d'un médicament.
Ce travail titanesque a abouti à des résultats qui pourront être repris par des chercheurs du monde entier. Cependant, il faut toutefois tempérer l'enthousiasme suscité par ce genre de découverte. Si effectivement C. elegans est un modèle de choix, il n'en reste pas moins que de nombreuses précautions s'imposent avant d'extrapoler à l'espèceespèce humaine. D'autre part, la seconde étude ayant été réalisée in vitro, on peut s'attendre à de mauvaises surprises in vivoin vivo car le passage de l'un à l'autre est loin d'être systématique. Il ne faut donc pas s'attendre à ce que, demain, d'un seul traitement, on se prémunisse de 300 pathologiespathologies.