au sommaire
La chimie du quartzquartz et la composition chimique de la silicesilice ou quartz alpha ont été établies par Berzélius à la fin du XIXe siècle, Von Rath a découvert la tridymite en 1868 et la cristobalite en 1884. Le quartz de haute température ou quartz β fut observé par Le Châtelier en 1889 et en 1900 Fenner étudia les conditions de stabilité des différentes espècesespèces.
D'autres polymorphes furent encore trouvés plus récemment par synthèse au laboratoire, puis dans la nature : la coésite (Coes 1953), la kéatite (Keat 1954) et la stishovite (Stishov et Popova 1961).

Le polymorphisme est la propriété qu'ont certains éléments et composés de cristalliser avec des structures différentes, la stabilité de chacune d'elles dépendant de la température et de la pression.
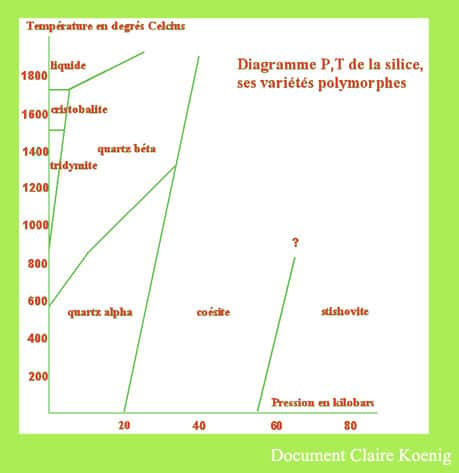
Voici donc le graphique, pression température, qui concerne le quartz.
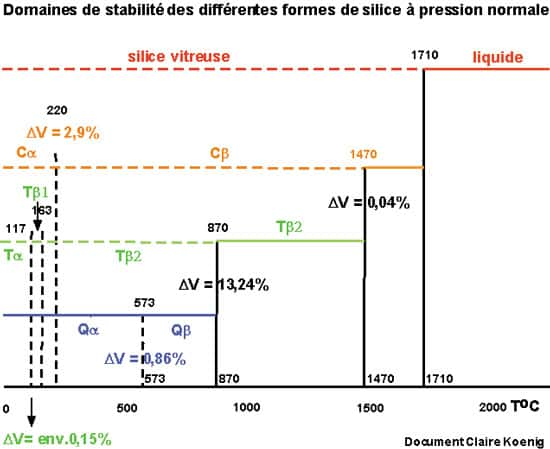
Et le schéma montrant, à pression atmosphériquepression atmosphérique, les zones de stabilité des différentes formes du quartz.
Différentes formes du quartz
À pression atmosphérique, on a du quartz α (hexagonal) de - 169 °C jusqu'à 573 °C, température critique, par exemple, en céramiquecéramique lors de la cuisson du biscuit, c'est-à-dire la première cuisson de la pièce. Puis du quartz β (hexagonal) de 573 à 870. Au-delà et toujours à Patm on a la tridymite jusqu'à 1470 et la cristobalite de 1470 à 1723 température de fusion de la silice. En passant de α à β les atomes de silice subissent une rotation de 6°52' autour de l'axe hélicoïdal de la structure.
La découverte de la diffractiondiffraction des rayons Xrayons X en 1912 et le développement de la radiocristallographie ont permis de comprendre les relations entre les différentes structures, d'identifier la structure des quartz cryptocristallinscryptocristallins et de constater que dans tous les cas on a la même « brique » de constructionconstruction : le tétraèdre de silice SiO2. Pour assurer la neutralité, chaque atome d'oxygèneoxygène est commun à 2 tétraèdres, ce qui permet la construction d'un édifice cristallin. On peut considérer le tétraèdre comme régulier, en effet, si l'angle O-Si-O idéal est de 109°29', on a les mesures suivantes pour le quartz α : 108°74 ; 110°04 ; 109°16 et 110°08. Pour l'angle Si-O-Si, la mesure de 143°90 indique une liaison intermédiaire entre une covalence (90°) et une liaison ioniqueliaison ionique (180°).
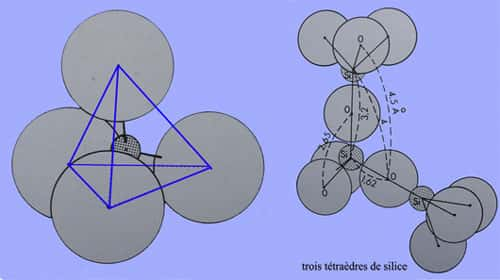
La structure cristalline du quartz α, décrite en 1929 par Gibbs est hexagonale.
La maille élémentaire, formée de 3 siliciumssiliciums et 6 oxygènes, a les dimensions suivantes : 4,903*10-10m et 5,394*10-10m. Et les tétraèdres sont assemblés par leurs atomes d'oxygène...
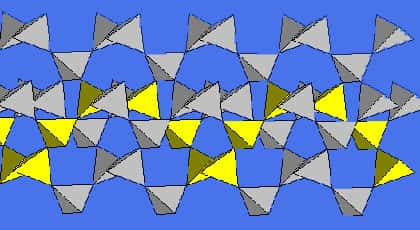
La distance Si-O est de 1,61*10-10m et l'enchaînement des tétraèdres se fait en hélice autour de l'axe ternaire soit à gauche soit à droite, ce qui donne des énantiomèresénantiomères gauche et droit du quartz qui dévient la lumièrelumière dans des directions différentes. Des énantiomères sont des moléculesmolécules qui sont l'image l'une de l'autre dans un miroirmiroir, elles ne sont donc pas superposables, comme les mains ! La structure gauche du quartz donne un cristal qui apparaît à l'observateur comme dextrogyredextrogyre, la lumière tournant dans le même sens que l'hélice structurale.
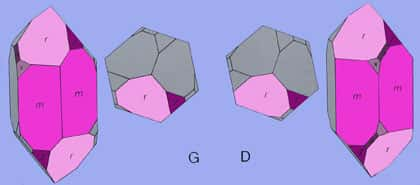
Le faciès des cristaux de quartz est très variable
Les trois les plus fréquents sont :
- le facièsfaciès prismatique le plus fréquent présente le prisme hexagonal 10-10 à faces plus ou moins striées horizontalement et les 2 rhomboèdres directs 10-11 et 01-11 comme formes dominantes, cristaux assez massifs en général avec un rapport largeur-longueur de 2/3 à 1/4. L'angle du dièdre est de 85°46' (Haüy). Les formes plus longues sont plus rares ;
- le faciès bipyramidal avec absence quasi totale du prisme, ce faciès est plus caractéristique du quartz béta ;
- le facies rhomboèdrique ou le prisme est absent et où les cristaux sont allongés selon l'axe c et présente des faces de rhomboèdres peu inclinées sur l'axe.
Les maclesmacles résultent de la croissance simultanée de deux ou plusieurs cristaux d'une même espèce, pris l'un dans l'autre selon des lois géométriques invariables.
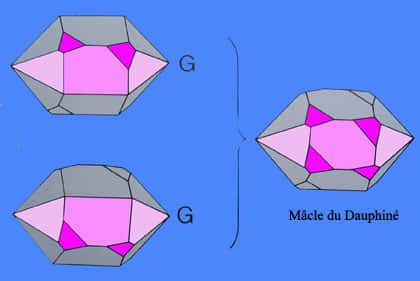
Pour le quartz α, les macles les plus connues sont la macle du Dauphiné, la plus fréquente dans laquelle les deux cristaux sont tournés de 180 degrés l'un par rapport à l'autre. Cette macle ne fait intervenir qu'une rotation et ne change pas la déviation de la lumière par le cristal mais modifie les propriétés piézoélectriques du cristal.
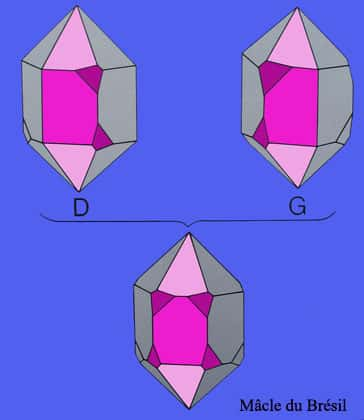
La macle du Brésil dans laquelle les axes binairesbinaires des deux individus sont opposés, les deux cristaux étant maclés en association droite-gauche. Cette macle est inutilisable en optique et en électricité. Enfin, la macle du Japon ou de la Gardette peu fréquente mais facile à identifier dans laquelle les cristaux font un angle rentrant de 84°33' et où une face de prisme est commune aux deux individus.

Propriétés physiques, chimiques et inclusions du quartz
Notons qu'il existe, et pour le quartz ceci a son importance, une proportionnalité entre la densité et l'indice de réfractionindice de réfraction.
De cassure conchoïdale, le quartz a une duretédureté de 7 sur l'échelle de Mohs avec de légères différences selon les faces. La densité du quartz transparenttransparent homogène est de 2,651 g/cm3 à 0 degré et de 2,649 à 20b °C. L'indice de réfraction 1,553 et 1,544, biréfringencebiréfringence de 0,009.
Il existe des tableaux des indices des différents quartz en fonction des différentes longueurs d'ondelongueurs d'onde de l'UVUV à l'IR avec cinq chiffres significatifs au moins, de même en fonction de la température, toutes ces données sont disponibles parce que le quartz est très utilisé en optique.
Le pouvoir rotatoire de 21°72' pour la lumière jaune (raie D) du sodiumsodium dans une lame monocristalline de 1 millimètre d'épaisseur (il dépend de l'épaisseur !). Il varie avec la longueur d'onde en suivant la loi de Biotloi de Biot (1/λ 2), mais aussi avec la température selon la loi de Le Chatelier.
Ont encore été très étudiées pour le quartz : l'absorptionabsorption de la lumière de l'UV à l'IR, la diffusiondiffusion de Rayleigh, la luminescence avec les RX et les neutronsneutrons rapides, le quartz étant utilisé dans l'industrie nucléaire pour ses propriétés électriques (constantes diélectriqueconstantes diélectrique et conductibilitéconductibilité), ses propriétés magnétiques, thermiques, mécaniques (clivagesclivages, dureté, ténacitéténacité...).
La piézoélectricitépiézoélectricité du quartz est une propriété physiquephysique très remarquable (voir chapitre sur la silice pure dans lequel cette propriété est traitée).
Le point d'ébullition de la silice a été déterminé théoriquement et expérimentalement. Les valeurs obtenues à pression atmosphérique sont de 3.070 K env. pour la valeur calculée et 2. 950 K env. pour la valeur mesurée. On conçoit qu'à des valeurs pareilles l'évaluation ou la mesure de température soit entachée d'incertitude... on retiendra 3.000 K pour simplifier.
Schick a mesuré à une température supérieure à 3.000 K, donc quand toute la silice est évaporée, les pressions partielles (en atmosphèresatmosphères à l'époque) des différents gazgaz en présence et il obtient les données suivantes, assez surprenantes au premier abord :
SiO 0,43 ; SiO2 0,04 ; Si2O2 5*10-5 ; O2 0,18 ; O 0,05 ; Si 1,3*10-6 pour un total de 0,70 atm. Beaucoup de décompositions et de recombinaisonsrecombinaisons moléculaires donc, à de telles températures.
Concernant les propriétés chimiques du quartz, nous retiendrons sa résistancerésistance à tous les agents chimiques, il n'est soluble que dans HF et une solution chaude de NH4Hf. Il n'est attaqué, que très lentement à froid, par les alcalis, et fortement à haute pression et haute température.
Sa solubilité aux agents atmosphériques à long terme, surtout sous climatclimat chaud, permet une érosion relativement rapide des granitesgranites par rapport à d'autres roches. Nous reviendrons sur la silice et l'eau !
Il peut y avoir des impuretés dans les cristaux de quartz.
Dans le réseau cristallinréseau cristallin, seuls Ti4+ dans le quartz rose et rarement Ge4+ peuvent remplacer Si. Les atomes Zr, Sn, Th, U fréquents aux mêmes endroits, sont en général trop gros et en plus hexacoordonnés et non tétracoordonnés comme Si.
Seul Al3+ remplace facilement Si, mais il faut introduire un cationcation dans le schéma pour que la neutralité électrique soit respectée (K+, Na+, Ca++, Li+ mais aussi Fe3+, Mn3+, ou B3+ mais plus rarement).
Dans un quartz incolore, on peut ainsi avoir 82 Al, 45 Li, 16 H et moins de 6 Na pour 106 atomes de silicium. Ou encore 41 Al, 22 Li, 8H et moins de 9 Na par million dans un quartz fumé... De même, quelques groupes OH peuvent remplacer l'oxygène.
Il peut y avoir de nombreuses inclusions dans des cristaux de quartz.
Une inclusion est constituée par un corps étranger caractérisé, il ne faut pas les confondre avec les impuretés des cristaux qui leur donnent leurs couleurscouleurs. Des inclusions solidessolides : le rutile en aiguilles ou en filaments (cheveux de VénusVénus), la tourmalinetourmaline, des cristaux d'amphiboleamphibole (œilœil-de-chat), des paillettes de mica (aventurine) ou des aiguilles de stibine, ou encore de l'argileargile plus ou moins ferrugineuse (quartz fantôme) sont fréquentes ou encore l'œil-de-tigretigre.
Mais il existe aussi des inclusions liquidesliquides, elles peuvent se rencontrer comme des solutions de gaz carboniquegaz carbonique ou de sels alcalins ou même des inclusions gazeuses de gaz carbonique.
Les quartz de haute température et de haute pression...
- La tridymite contient 4 siliciums et 8 oxygènes par maille, dont les dimensions sont 5,04*10-10m par 8,24*10-10m. La structure est plus ouverte et la densité passe de 2,65 à 2,26 seulement ! La tridymite α existe jusqu'à 117° et la tridymite β de 117 à 163 °C à pression atmosphérique.

- La cristobalite peut exister sous forme métastablemétastable jusqu'à des températures de 220 degrés. La cristobalite α est quadratique et existe en dessous de 220 °C ; la cristobalite β, qui existe entre 220 à 1.470 °C, est cubique arête du cube : 7,13*10-10m. La maille contient 8 siliciums et 16 oxygènes. L'arrangement est peu compact avec une densité de 2,2. Les cristaux sont très petits.

En l'absence de minéralisateur (impuretés choisies ou non à des concentrations très faibles, même inférieures à 1 ppmppm !), le quartz ne se transforme jamais en tridymite à pression atmosphérique (G. Friedel). Certains scientifiques (O.W. Flörke) nient même l'existence de tridymite à Patm. On aurait alors une transformation directe quartz-cristobalite vers 1.050 degrés Celsiusdegrés Celsius... Dans l'industrie, la pureté à 100 % n'existe pas, donc la tridymite se forme et c'est tant mieux, en l'occurrence, puisque l'augmentation de volumevolume du Tα Tβ est beaucoup plus faible que l'augmentation de volume Cα Cβ. De très nombreux travaux se rapportent à ce problème dans la littérature, il est en effet capital pour l'industrie de la silice réfractaireréfractaire (briques, fours etc.).
- La coésite a été découverte par Sosman en 1954 et dédiée à Coes un chimiste américain, la localité type est le Meteor CraterMeteor Crater, États-Unis (la localité type est la localité de référence pour une roche ou un minéralminéral en géologiegéologie).
Le quartz a un volume molairemolaire de 2,27 cm3 et est stable à la surface du globe jusqu'à environ 100 kilomètres. La coésite, avec un volume molaire de 2,06 cm3, est stable à des profondeurs supérieures à 100 km. Au-delà de cette profondeur, le quartz se transforme en coésite. La transformation peut se réaliser dans l'autre sens au cours de la remontée. Minéral incolore très réfringent donc facile à distinguer du quartz dans une coupe microscopique, il cristallise dans le système monocliniquesystème monoclinique.
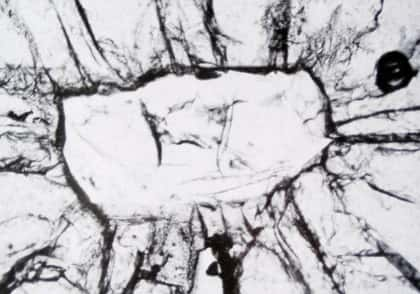
La transformation de la coésite en quartz comme marqueur pétrogénétique
Dans l'image ci-dessus il y a des fractures concentriques d'un cristal de grenat avec, au centre, un reste de cristal de coésite.
Si une roche remonte de la profondeur vers la surface, les conditions de pression et de température changent et donc les cristaux en présence. Ainsi, une coésite va se transformer en quartz, moins dense avec une augmentation de volume de 10 % environ... oui mais, si le cristal de coésite se trouve prisonnier d'un gros cristal de grenat par exemple, (qui, lui, ne se transforme pas en remontant parce que stable à ces conditions de pression et température), il se trouve ceinturé et le minéral hôte, disons le grenat, empêche sa transformation jusqu'à la limite de sa résistance mécanique. À ce moment, le cristal hôte - donc le grenat - se fend de manière concentrique et les fractures pénètrent dans le cristal qui résiste encore un peu de telle façon que la pression dans le cristal soit plus forte qu'à l'extérieur de celui-ci. Cette résistance résiduelle permet à un petit morceau de coésite de « survivre » au centre du grenat parce que la transformation n'arrive pas à son achèvement. On peut ainsi avoir une coexistence de coésite stable et de quartz stable.
Plus tard, quand le minéral sera remonté jusqu'en surface la transformation de la coésite métastable sera très très lente, si bien que l'assemblage minéralogique reste ainsi figé... Ces structures sont des témoins de grande valeur pour démontrer l'existence de très hautes pressions dans les phénomènes métamorphiques et on trouve ces structures dans les éclogites, par exemple, qui sont les témoins d'un métamorphisme très intense de grande profondeur. Ces inclusions peuvent aussi exister dans du disthènedisthène, de la tourmaline, de l'allaniteallanite. Les texturestextures d'une grande importance pétrogénétique sont celles qui contiennent un autre minéral, par exemple un clinopyroxèneclinopyroxène avec les différentes phases de silice dans le même cristal de grenat (par exemple). En effet, elles prouvent que la coésite a coexisté dans un assemblage triphasé, dans notre exemple : coésite + clinopyroxène + grenat, ce qui n'est pas évident si on n'a que la silice !
- La kéatite est une substance synthétique, produite en labo, qui n'a pas encore été trouvée dans la nature. Elle n'est donc pas considérée comme un minéral (!) et est étudiée par les chimistes et les physiciensphysiciens mais pas par les géologues. Système quadratiqueSystème quadratique. Produite sous pression de vapeur d'eau élevée.
- La stishovite formée à très haute pression mais pas forcément à très haute température, on trouve difficilement des cristaux parce qu'elle n'a pas beaucoup de temps pour cristalliser ! Elle se forme dans les cratères d'impact et c'est aussi dans le Meteor Crater que les premiers tout petits cristaux furent trouvés. La structure de base est beaucoup plus compacte que celle des autres formes du quartz : sa densité de 4,28 (au lieu de 2,65) et son indice de réfraction de 1,81 (au lieu de 1,55 chez le quartz alpha) sont si différents qu'il est difficile de croire qu'il s'agit du même composé chimique ! Elle est formée de chaînes parallèles d'octaèdres composés d'un ionion silicium entouré de 6 oxygènes et c'est cette structure parallèle qui est responsable du système prismatique dans lequel elle cristallise. Métastable dans les conditions normalesconditions normales, elle recristallise en quartz α lentement. C'est un phénomène assez lent parce qu'il nécessite la rupture de liaisons et le réarrangement des atomes.
Elle fut synthétisée (avant d'être trouvée dans la nature !) par Stishov et Popova en 1961 à une température de 1.200 à 1.400 °C et une pression de 115.000 atm. Wentorf en a obtenu une seconde fois en soumettant pendant une minute de la silice vitreuse à 1.000-1.600 °C à des pressions de 130 kilobarskilobars.
Les formes fibreusesfibreuses (terme général : calcédoine) où les cristaux ne sont plus individualisables au microscope optiquemicroscope optique et s'empilent pour former des fibres. Elles comprennent plusieurs espèces suivant les caractères optiques. Citons pour terminer un polymorphe de la silice qui est la silice fibreuse, dite silice W de Weiss, orthorhombique et obtenue en chauffant du monoxyde de silicium à l'airair entre 1.200 et 1.400 °C. Cette forme de silice est métastable à Patm et va se transformer lentement en quartz.
Dans les polymorphes de la silice, il faut inclure l'opaleopale, qui est de la silice hydratée, et les verresverres qui sont de la silice amorpheamorphe... voir chapitres suivants.