au sommaire
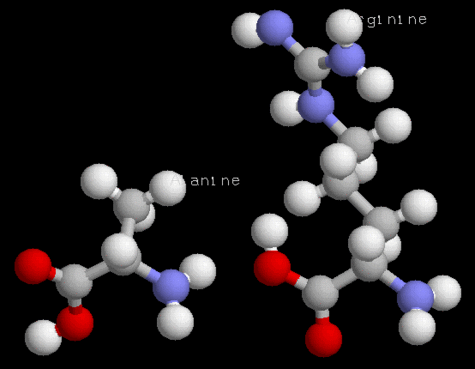
Acides aminés (alanine, arginine)
L'aspartate kinase est une enzymeenzyme intervenant dans la synthèse des acides aminés dits essentiels, que notre organisme n'est pas capable de synthétiser, et que nous devons trouver dans notre alimentation. Chez les plantes et les micro-organismes, l'aspartate kinase catalysecatalyse la première étape de la voie de synthèse d'une famille de quatre acides aminés essentiels1.
Les chercheurs ont montré que ce sont des changements de conformationconformation2 qui modifient son activité. La connaissance de sa structure tridimensionnelle est donc essentielle pour comprendre et contrôler son fonctionnement. L'altération de l'aspartate kinase dans son contrôle des acides aminés terminaux permettrait d'augmenter la teneur en acides aminés essentiels et donc la valeur nutritionnelle des plantes destinées à l'alimentation animale.
La connaissance des voies de biosynthèse des acides aminés devrait également permettre, à terme, de cibler une étape donnée de cette biosynthèse.
notes :
1 La lysinelysine, la thréoninethréonine, la méthionineméthionine et l'isoleucineisoleucine, dérivées de l'aspartate soit quatre des neuf acides aminés essentiels.
2 Conformation d'une protéineprotéine : structure spatiale de la chaîne d'acides aminés