au sommaire
L'histoire a fait beaucoup de bruit et semé l'appréhension en Europe au cours des années 1990. À l'époque, certaines vachesvaches souffraient d'un mal étrange appelé maladie de la vache folle, ou encéphalopathie spongiforme bovineencéphalopathie spongiforme bovine (ESB). L'information a alors été largement relayée par les médias, car de la viande contaminée a circulé sur le marché. Ce scandale sanitaire a atteint plus de 200 individus, touchés par la maladie de Creutzfeldt-Jakob. Comme c'est le cas chez les animaux, cette pathologie mortelle induit un gonflement vacuolaire et transforme progressivement le cerveau en une sorte d'éponge. Cette affaire a pris le nom de « crise de la vache folle ».
La maladie n'est pourtant pas la première du genre. Au XVIIIe siècle, on connaissait déjà la tremblante du moutontremblante du mouton, une atteinte neurologique frappant le bétail. Chez l'Homme, la maladie de Creutzfeldt-Jakob a été décrite au début des années 1920, et une maladie similaire, appelée kuru, a été identifiée à cette époque dans une tribu anthropophage de Nouvelle-Guinée. Ces pathologies sont classées dans la catégorie des encéphalopathies subaiguës spongiformes transmissibles (ESST), car elles sont infectieuses et rendent le cerveau spongieux. Cependant, le facteur responsable était jusque-là inconnu, et appelé « virus non conventionnel ».
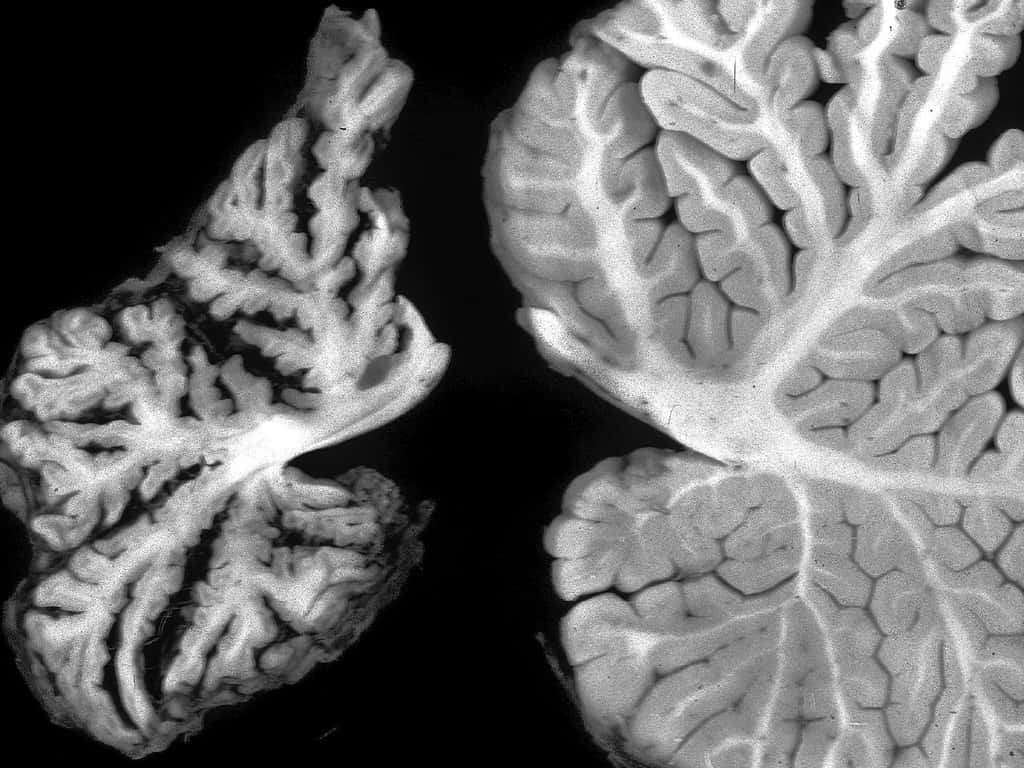
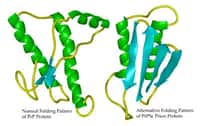
Le prion est une protéine naturelle qui se replie, change de forme et devient nocive. Il s’accumule dans le cerveau et induit un gonflement vacuolaire, ce qui le fait ressembler à une sorte d’éponge. On observe à droite une coupe de cerveau normal, et à gauche une coupe de cerveau contaminé. © gliageek, Flickr, cc by nc sa 2.0
Les prions, une nouvelle catégorie d’agents infectieux
C'est en 1982 que le mystère fut enfin éclairci. Stanley Prusiner découvrit que les ESST étaient provoquées par l'accumulation dans le cerveau de protéines anormales, qu'il appela prionsprions. Il montra qu'en injectant de telles protéines dans le cerveau de souris en bonne santé, on pouvait les rendre malades. Il déclara alors que le prion était un tout nouvel agent infectieux, au même titre que les bactériesbactéries ou les virus. Ces travaux lui valurent d'ailleurs le prix Nobel de médecine en 1997.
Depuis cette découverte, de nombreuses recherches sont en cours pour connaître l'origine et le mode d'action du prion. Cette moléculemolécule dérive d'une protéine qui existe à l'état naturel chez tous les mammifèresmammifères. Pour une raison inexpliquée, cette protéine peut se replier et changer de forme. Elle devient alors nocive, s'accumule dans le cerveau et provoque la mort progressive des neurones. Certains spécialistes pensent que l'impact des prions va au-delà des ESST. Des études suggèrent qu'ils auraient un rôle dans le développement d'autres maladies neurologiquesmaladies neurologiques, comme Alzheimer.
L’imiquimod, un inhibiteur de prions
De nombreuses équipes s'intéressent au moyen de combattre cet agent pernicieux. Récemment, des chercheurs français de l'Inserm ont fait un pas en avant dans ce domaine. Ils ont identifié un médicament possédant des vertus antiprions. Ce médicament, dont le principe actifprincipe actif est l'imiquimod, circule déjà sur le marché pour traiter certains cancers de la peaucancers de la peau et des infections virales. Ces résultats, publiés dans la revue Plos One, pourraient bien lui donner une seconde vie dans la lutte contre les maladies à prion.
Pour ces travaux, les auteurs se sont tout d'abord intéressés à la levure de boulangerlevure de boulanger, Sacharamyces cerevisiae, un micro-organisme possédant des prions complètement inoffensifs. Ils ont testé de nombreuses molécules sur cet organisme unicellulaire, et ont constaté que l'imiquimod réduisait la présence de prions dans les cellules. Les scientifiques sont alors passés aux cellules de mammifères et ont également mis en évidence une activité antiprion. Enfin, l'imiquimod a été injecté à des souris contaminées et s'est montré capable d'inhiber le développement des prions.
« À ce stade, nous ne savons pas encore comment l'imiquimod agit chez l'hôte ni comment les prions disparaissent », expliquent Cécile Voisset et Marc Blondel, participants à ces travaux, dans un communiqué de presse de l'Inserm. Ces travaux ouvrent cependant des pistes de traitement pour lutter contre les prions. L'équipe s'est penchée sur ce projet et a mis au point une nouvelle voie de synthèse de l'imiquimod, dont la production était jusque-là difficile et coûteuse. « Nous avons mis au point trois composés proches de l'imiquimod qui présentent une activité anti-prion. L'imiquimod reste cependant la molécule la plus active », poursuivent les chercheurs. Leur travail se poursuit pour développer des dérivés plus performants.