au sommaire
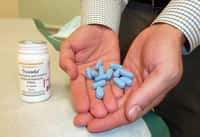
Depuis janvier 2013, l'association Aides réclame la mise à disposition du Truvada. C'est désormais chose faite. Marisol Touraine a en effet confirmé le droit de prescription de cette molécule antiviralemolécule antivirale « temporairement et sous certaines conditions », ce lundi 23 novembre à l'Assemblée, à l'occasion du débat sur le projet de loi de financement de la Sécurité sociale. À compter de la mi-décembre 2015, le Truvada pourra donc être délivré aux patients séronégatifs en préventionprévention du risque de contamination par le VIH. Cette molécule devrait être entièrement remboursée par l'Assurance maladie à la rentrée 2016.
Aux États-Unis, cette combinaison d'antirétroviraux est commercialisée depuis 2013 pour lutter contre le Sida. Avec cette avancée, la France deviendrait le premier pays européen à délivrer ce traitement en prophylaxie. « De nombreux efforts restent à accomplir, en France comme au niveau international, mais grâce à la PrEP [prophylaxie pré-exposition, NDLRNDLR], nous serons mieux armés pour combattre l'épidémieépidémie », explique Aurélien Beaucamp, président de l'association Aides. La prescription de cette molécule est en effet une stratégie préventive visant à briser les chaînes de transmission virale, en complément de l'usage du préservatif.
Rappelons que début novembre, l'ANSM (Agence nationale de sécurité du médicament et des produits de santé) avait rendu un avis favorable sur le Truvada, et s'était exprimée pour la mise en place d'une Recommandation temporaire d'utilisation (RTU) réservée « aux personnes à haut risque du VIH par voie sexuelle ».