au sommaire
- Visitez notre galerie photo sur l'ADN

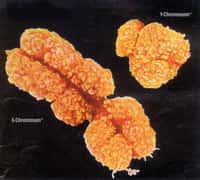
Alors que tous les chromosomes autosomaux (non sexuels) sont présents en doubles exemplaires chez les mammifèresmammifères des deux sexes, il existe une différence importante pour les chromosomes sexuels. Chez les femelles, toutes les cellules sont dotées de deux chromosomes X, alors qu'un chromosome Y fait office de second chromosome sexuel chez les mâles.
Le chromosome masculin étant bien plus petit que son homologue féminin (150 millions de paires de bases pour le X et seulement 57 millions pour le Y), il code donc pour un nombre moindre de gènes. Les femmes posséderaient donc une double ration de gènes portés par les chromosomes X s'il n'existait pas un mécanisme biologique naturel capable d'équilibrer l'expression des gènes sexuels chez les deux sexes : c'est ce que l'on appelle l'inactivation du chromosome X.
Un processus aléatoire
Ce mécanisme consiste en une extinction forcée de l'un des deux chromosomes X dans chaque cellule, dès l'embryogenèse, de sorte que seul l'un des deux puisse exprimer librement ses gènes, l'autre étant conservé dans un état silencieux. Par ce biais, le niveau d'expression des gènes du chromosome X est donc identique quel que soit le sexe.
Phénomène étrange, le chromosome inactivé dans chaque cellule semble être choisi de façon aléatoire. Dans certaines cellules, le chromosome X éteint est d'origine paternelle, alors que la cellule d'à côté peut avoir éteint le chromosome hérité de la mère. Toutefois, une fois ce choix réalisé, il se transmet de façon stable aux cellules filles à chaque division cellulaire. Des groupes de cellules adjacentes possèdent donc les mêmes propriétés, comme ce que l'on observe aisément chez les chats femelles dits écaille de tortuetortue, dotés d'un pelage tacheté de noir, de roux et de blanc (où le gène de la couleurcouleur est localisé sur le chromosome X).
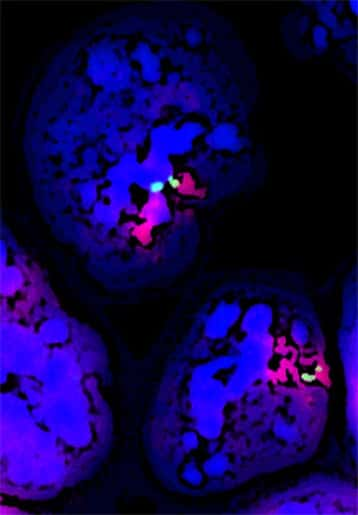
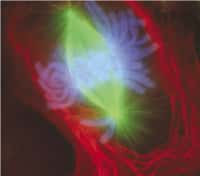
Les chromosomes X sont inactivés de façon aléatoire au cours du développement embryonnaire (en bleu l'ADN, en vert les chromosomes X et en rouge les ARN Xist). © Edith Heard, Institut Curie, Image du communiqué du CNRS
Les gènes Xist et Tsix
Le hasard de cette inactivation est connu depuis longtemps, mais sa mise en place demeurait un mystère pour les scientifiques. Ils savaient toutefois que des gènes codés par les chromosomes X étaient impliqués dans ce choix.
En effet, une région particulière du chromosome X, le centre d'inactivation, produit deux ARN non traduits appelés Xist (pour X-inactive specific transcript) et Tsix. Ils possèdent des séquences nucléotidiques complémentaires qui permettent au second de réguler la production du premier, lequel est directement impliqué dans le phénomène d'inactivation. Au départ synthétisé de façon équivalente par les deux chromosomes X, l'ARN Xist finit par n'être exprimé que par le chromosome inactivé, qui se retrouve littéralement recouvert par ces transcrits.
Les chromosomes dansent et interagissent
Mais les gènes ne sont pas les seuls responsables du phénomène d'inactivation. Une interaction directe et savamment orchestrée entre les deux chromosomes X a pu être mise en évidence par une équipe de chercheurs menée par Edith Heard (Institut Curie/CNRS UMR 3215/Inserm U934), en observant en temps réel des cellules embryonnaires de souris. Les chromosomes subissent en effet une augmentation de leur mobilité, menant à des collisions entre les deux centres d'inactivation.
Au départ tout va très vite ; les mouvementsmouvements sont courts et rapides. Puis vient une période plus longue où les deux chromosomes sont comme liés l'un à l'autre, selon les résultats parus dans la revue Cell. Cette interaction entraîne une diminution de l'expression de Tsix par l'un des deux chromosomes, ce qui permet à Xist d'être plus abondamment exprimé par ce même chromosome. Celui-ci fera donc l'objet de l'inactivation.
Des différences entre espèces
Si ce ballet a lieu à priori chez tous les mammifères, de grosses différences ont été observées entre les espècesespèces par la même équipe de recherche, d'après l'article publié dans la revue Nature. Chez la souris, le chromosome d'origine paternelle est toujours inactivé en premier, à des stades précoces du développement embryonnaire, puis est réactivé. Le choix définitif du chromosome à éteindre ne sera réalisé que plus tard. En revanche, chez les humains ou le lapin, cette première inactivation n'est pas retrouvée, de même que Tsix ne semble pas avoir un rôle aussi important que chez la souris.
« Certaines des observations préalablement faites chez la souris ne peuvent pas forcement être étendues aux autres espèces. Néanmoins, la compréhension du processus d'inactivation du chromosome X chez les mammifères s'est beaucoup basée sur les études faites chez la souris, qui reste un beau modèle pour la compréhension des mécanismes épigénétiques », a expliqué Edith Heard dans le communiqué du CNRS.