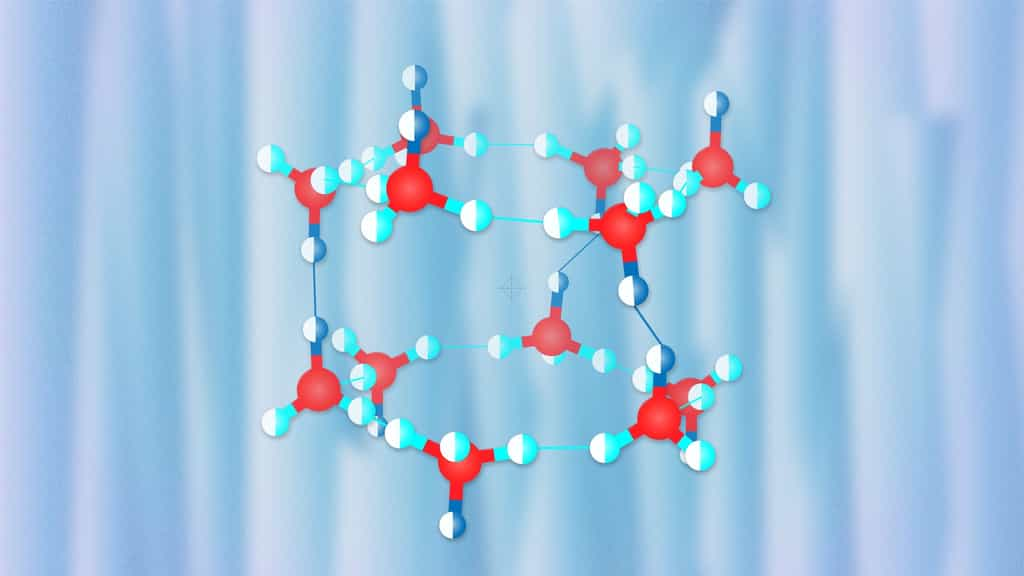
Les clathrates se comportent comme des pièges moléculaires pour certains gaz. Le plus connu est l’hydrate de méthane qui se trouve à l’état naturel dans les océans mais des clathrates d'hydrogène existent également et sont tout aussi intéressants comme le prouve la découverte d'un nouveau type de glace. Ils pourraient permettre de stocker l'hydrogène produit par les énergies renouvelables.
au sommaire
Aucune étude sérieuse ne permet de penser que nous pourrons nous passer de l’énergie nucléaire dans les décennies à venir, bien au contraire. Mais il est tout aussi certain que les énergies renouvelablesénergies renouvelables vont également monter en puissance et qu'en appoint de l'atome, il faudra trouver des moyens aussi efficaces et peu onéreux que possible pour stocker l'énergie électrique produite par intermittence par les éolienneséoliennes et les panneaux solaires.
L'hydrogène apparait comme un moyen intéressant de stocker de l'énergie électrique mais, bien évidemment, ce n'est pas aussi simple que l'on pourrait le croire. On sait produire de l'hydrogène par électrolyse mais cela veut dire qu'il y a un rendement pour cette conversion. La question se reposera avec la reconversion de l'hydrogène en électricité, par exemple avec une pile à combustible. On comprend facilement qu'il faudrait donc, autant que possible, pouvoir utiliser directement de l'électricité car, en fait, un facteur de rendement devra être appliqué deux fois. Imaginons que ce facteur soit de 0,5, in fine, seul un quart de l'énergie initialement produite par du solaire ou de l'éolien sera utilisable si on la stocke. La question est encore plus problématique si on veut faire du stockage à haute densité car il faut alors, par exemple, compresser voir liquéfier l'hydrogène ce qui est aussi très énergivore. L'idée de le stocker directement sous forme solide dans un matériaux qui l'absorbe est donc à considérer.
L'hydrogène est une des clés de la transition énergétique du XXIe siècle. © CEA Recherche
Il n'y a pourtant pas de doute que le stockage de l'énergie sous forme d'hydrogène soit destiné à un avenir plus ou moins brillant, avenir qui va dépendre de la capacité de le stocker facilement à moindre coût. À cet égard, on ne peut que suivre avec intérêt les travaux concernant les clathratesclathrates d'hydrogène encore appelés clathrates hydrates. Ce sont des clathrates contenant de l'hydrogène moléculaire au sein d'une sorte de cage polyédrique formée de moléculesmolécules d'eau et ils se présentent donc sous des aspects similaires aux glaces d'eau constituant les clathrates de méthane dont Futura avait déjà parlé dans le précédent article ci-dessous.
Or, justement, une équipe internationale de physiciensphysiciens et de chimistes de la Carnegie Institution of Washington (USA), de l'Institute of Solid State Physics à Hefei (Chine) et menée par le célèbre physicien Artem R. Oganov, professeur au Skolkovo Institute of Science and Technology (Skoltech), vient de faire une annonce intéressante avec un clathrate d'hydrogène dans un article publié dans les Physical Review Letters mais en accès libre sur arXiv.
De nouveau, le chercheur s'est appuyé avec ses collègues sur des simulations numériquessimulations numériques conduites avec un algorithme de sa création nommé Uspex (Universal Structure Predictor : Evolutionary Xtallography) pour en tirer des prédictions. Comme Futura le rappelait dans un article récent consacré à la physiquephysique et à la chimiechimie de l'intérieur des géantes de glace du Système solaireSystème solaire que sont Uranus et Neptune, Uspex est utilisé par plus de 7.000 chercheurs dans le monde car il permet de prédire et d'explorer victorieusement (en russe uspekh signifie « succès ») la structure cristalline que vont adopter les atomes formant un matériaumatériau d'une composition chimique initiale donnée dans des conditions de pressionspressions et de températures arbitraires.
Une présentation d'une star de la physique russe et de ses travaux en physique du solide. Pour obtenir une traduction en français assez fidèle, cliquez sur le rectangle blanc en bas à droite. Les sous-titres en russe devraient alors apparaître. Cliquez ensuite sur l'écrou à droite du rectangle, puis sur « Sous-titres » et enfin sur « Traduire automatiquement ». Choisissez « Français ». © Skoltech
La fascinante physique des phases de la glace
« Ce n'est pas la première fois que nous nous tournons vers les hydrates d'hydrogène. Dans nos recherches précédentes, nous avions prédit un nouvel hydrate d'hydrogène avec 2 molécules d'hydrogène par molécule d'eau, explique Artem Oganov dans un communiqué du Skoltech. Malheureusement, cet hydrate exceptionnel ne peut exister qu'à des pressions supérieures à 380.000 atmosphèresatmosphères, ce qui est facile à réaliser en laboratoire, mais est difficilement utilisable dans des applicationsapplications pratiques. Notre nouvel article décrit des hydrates qui contiennent moins d'hydrogène mais qui peuvent exister à des pressions beaucoup plus basses ».
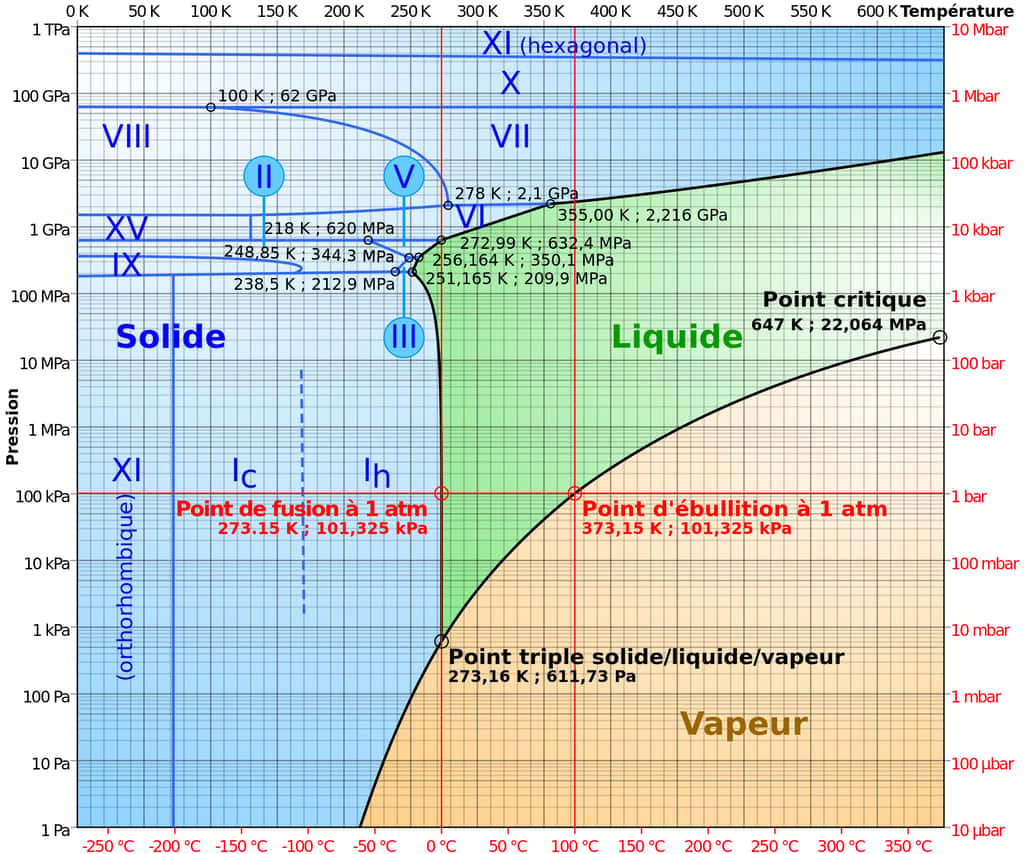
Comme Futura l'expliquait dans le précédent article ci-dessous, il existe plusieurs formes de glace d'eau pure. C'est ce qu'une série de découvertes initiées au début du XXe siècle par le physicien et chimiste germano-balte Gustav Tammann, a montré en utilisant des hautes pressions.
La glace ordinaire a été appelée de type Ih. Elle possède un réseau cristallinréseau cristallin de forme hexagonale, d'où le « h » -- la structure cristalline acceptée de la glace ordinaire suit les règles dites de Bernal-Fowler, d'après les physiciens britanniques John Desmond Bernal et RalphRalph H. Fowler qui les ont décrites pour la première fois en 1933. Elles ont été reprises par le prix Nobel de Chimie Linus PaulingLinus Pauling en 1935.
Tammann a montré l'existence d'une glace de type II qui s'est révélée bien ordonnée à hautes pressions, ce qui n'est pas le cas de la glace Ih où un certain degré de désordre est encore présent dans le réseau cristallin. En effet, les protonsprotons des atomes d'hydrogène n'occupent pas des sites particulièrement ordonnés, contrairement aux atomes d'oxygèneoxygène (plus exactement, si les atomes d'oxygène forment bien un réseau régulier, les molécules d'H2O sont orientées de façon désordonnée). Le cas extrême est celui de la glace amorpheamorphe où les molécules d'eau sont aussi désordonnées qu'en phase liquideliquide.
On suspectait l'existence d'une glace désordonnée de type II, toujours au niveau des protons, et c'est précisément ce type de glace -- ou plus exactement sa réalisation avec un nouveau clathrate d'hydrogène au niveau des atomes d'oxygène -- qui semble bel et bien avoir été obtenu par les chercheurs de la Carnegie Institution of Washington et de l'Institute of Solid State Physics à Hefei dirigés par Alexander F. Goncharov, professeur dans ces deux institutions. C'est ce qu'indiquent des expériences de diffractiondiffraction avec des rayons Xrayons X et utilisant la spectroscopie Ramanspectroscopie Raman (des études plus poussées par diffraction de neutronsneutrons seront tout de même pertinentes) sur un tel hydrate d'hydrogène synthétisé sous une pression de 1.2 GPa... mais à température ambiante.
Le nouveau clathrate d'hydrogène découvert semblait inhabituel avec 3 molécules d'eau par molécule d'hydrogène, mais sa structure semble tout à fait compatible avec les prédictions générées par les simulations numériques menées avec Uspex. Cette découverte ne présente pas seulement un intérêt potentiel pour le stockage de l'hydrogène. En effet, on peut s'attendre à la présence de clathrates d'hydrogène dans des environnements astrophysiquesastrophysiques variés, des comètes aux luneslunes glacées des planètes géantesplanètes géantes en passant par les planètes naines.
La saga de la découverte de l'hydrogène et ses applications. © CEA Recherche

La glace XVI, une clé pour l'énergie du futur ?
Article de Laurent SaccoLaurent Sacco publié le 13/12/2014
Les clathrates se comportent comme des pièges moléculaires pour certains gazgaz. Le plus connu est l'hydrate de méthane que l'on peut trouver à l'état naturel dans les océans. Pour exploiter cette source d'énergie et afin de mieux les connaître, les chercheurs ont synthétisé un nouveau type de glace baptisé glace XVI.
Rien ne semble plus banal que la glace d'eau ? Faux. D'abord, contrairement aux autres liquides, l'eau augmente de volumevolume quand elle gèle. Plus légère, alors, elle flotte. Mais cela n'est vrai que lorsque l'on considère la forme de la glace qui est pour nous la plus ordinaire. Il existe en effet, et c'est relativement peu connu sauf des physiciens et des chimistes confrontés au sujet, plusieurs types de glace apparaissant dans différentes phases selon les conditions de température et de pression. On en connaît ainsi plus d'une dizaine de formes cristallinesformes cristallines.
La première découverte par l'humanité a été classifiée au début du XXe siècle par Gustav Tammann, sous l'appellation de glace Ih (la lettre h indiquant qu'elle fait partie des cristaux dont la maille cristallinemaille cristalline est hexagonale). Tammann a aussi découvert les glaces de type II et III. Pionnier de la physique des hautes pressions, le physicien P.W Bridgman a contribué à l'extension de notre connaissance des types de glace en fabriquant, en 1912, d'abord les glaces V et VI puis, en 1937, la glace VII. Ces connaissances nous permettent de spéculer sur la structure interne des planètes géantes comme Jupiter et NeptuneNeptune.
Des chercheurs ayant utilisé les faisceaux de neutrons disponibles à l'Institut Laue-Langevin (ILL) viennent de publier dans Nature, les résultats de leurs travaux sur un nouveau type qui est la moins dense de toutes les formes de glaces connues. Il s'agit de la glace XVI.
La glace XVI, un laboratoire pour comprendre les clathrates
L'intérêt de ces travaux vient de ce qu'il concerne directement les propriétés des clathrates (du grec klathron qui signifie fermeture) à base de molécules d'eau. Il s'agit de composés possédant une structure cristalline et formant des sortes de cages moléculaires enfermant d'autres molécules ou des atomes. Le clathrate le plus connu est l'hydrate de méthane. Il défraye régulièrement la chronique, car ceux qui sont présents dans le permafrostpermafrost et dans de vastes couches sédimentaires à des centaines de mètres au fond des océans sont potentiellement instables et risque de libérer d'immense quantité de méthane dans l'atmosphère à cause du réchauffement climatique.
Or ce gaz qui constitue aussi une source d'énergie est un gaz à effet de serregaz à effet de serre particulièrement puissant.
On étudie donc les gisementsgisements naturels considérables d'hydrate de méthane pour deux raisons contradictoires. Ils constituent à la fois une menace pour la survie de l'humanité, car ils pourraient provoquer un emballement spectaculaire du réchauffement climatiqueréchauffement climatique, et ils pourraient aussi contribuer à résoudre le problème de l'énergie au XXIe siècle et donc, a contrario, assurer la survie de larges populations.
Les chercheurs ont de bonnes raisons de penser que la structure de la glace XVI est représentative de celle d'hydrate de méthane et d'autres clathrates. Son étude a donc le potentiel de livrer certains secrets de la physique et de la chimie des clathrates précieux aussi bien pour protéger la planète que pour les exploiter comme source d'énergie.
Mais encore fallait-il créer cette glace qui s'apparente à ce que l'on peut appeler un clathrate vide.
Les clathrates, un puits de carbone et une source de méthane
Pour ce faire, les physiciens et les chimistes en ont synthétisé rempli de molécules de néonnéon (formées de petits atomes, elles permettent de vider le clathrate sans compromettre sa fragile structure), qu'ils ont ensuite extrait en plaçant le clathrate dans un vide à une température avoisinant 140 K. Les faisceaux de neutrons disponibles à l'ILL ont été diffractés par le matériau au cours de sa formation, ce qui a permis de s'assurer que l'on obtenait bien un clathrate et de recueillir des renseignements sur sa structure.
Selon Thomas Hansen, l'un des chercheurs impliqué dans les travaux sur la glace glace XVI : « Il faut savoir que l'on peut aussi former des clathrates avec du dioxyde de carbone, qui est stable dans les conditions des fonds océaniques. Cela signifie qu'il existe une possibilité d'extraire le méthane de son hydrate pour le transformer en énergie utile, en le remplaçant par le CO2. Autrement dit, on pourrait envoyer le CO2 au fond des océans pour prendre la place du méthane dans les clathrates. Un défi de taille, certes, et dont la faisabilité pose question, mais cela reste une possibilité fascinante qui vaut la peine d'être approfondie »