au sommaire
Une des stratégies actuelles pour limiter les effets secondaires des traitements anticancéreuxanticancéreux consiste à développer des nanomédicaments, systèmes transporteurs à l'échelle nanométrique acheminant des principes actifsprincipes actifs vers les cellules tumorales. On parle de thérapiesthérapies « physiques » lorsque ces principes actifs, des molécules ou des nanoparticules, peuvent être activés à distance par des stimuli physiques externes comme la lumière ou le champ magnétique.
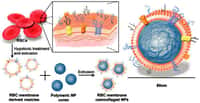
Dans ce contexte, des chercheurs des laboratoires Matière et systèmes complexes (CNRS, université Paris Diderot) et Physicochimie des électrolytes et nanosystèmes interfaciaux (CNRS/UPMC) ont développé un transporteur d'un nouveau type. Celui-ci combine photosensibilité et magnétisme. Pour cela, ils ont tout d'abord encapsulé des nanoparticulesnanoparticules magnétiques dans le compartiment interne d'un liposomeliposome (une vésicule artificielle avec un compartiment interne formé par des bicouches lipidiques), en quantité suffisante pour le rendre ultra-magnétique, avant d'insérer des photosensibilisateurs dans sa bicouche lipidique, tout en conservant une taille optimale pour la circulation sanguine.
En injectant ces liposomes directement dans la tumeurtumeur, chez la souris, cette combinaison de nanoparticules magnétiques et de photosensibilisateurs a permis aux chercheurs de combiner deux techniques pour détruire intégralement les cellules cancéreuses.
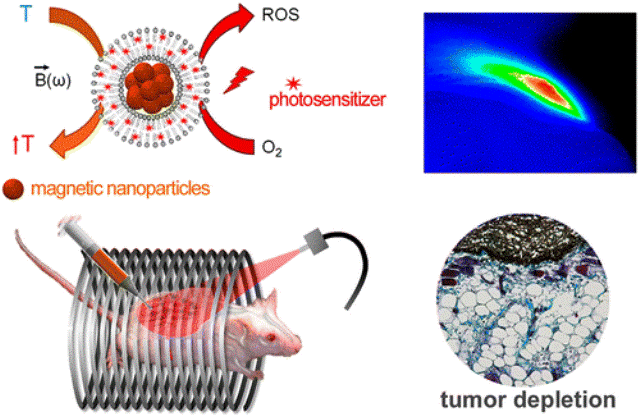
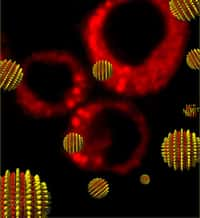
Des nanoparticules magnétiques (magnetic nanoparticles) peuvent être chauffées à l'aide d'un champ magnétique alternatif (B sur le schéma en haut à gauche). Sous l'action de la lumière (photosentitizer), elles peuvent aussi libérer des espèces chimiques oxygénées. Des tests très probants ont été effectués sur la souris pour détruire ainsi des cellules tumorales (tumor depletion). © American Chemical Society
Hyperthermie magnétique et photothérapie dynamique
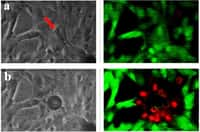
La première technique, l'hyperthermie magnétique, consiste à exciter les nanoparticules avec un champ magnétique pour augmenter la température de la tumeur et la détruire. La deuxième thérapie, dite photothérapie dynamiquephotothérapie dynamique, est rendue possible grâce aux photosensibilisateurs, qui libèrent, lorsqu'ils sont éclairés, des espècesespèces réactives de l'oxygène. Ces espèces chimiquesespèces chimiques sont oxygénées telles des radicaux libresradicaux libres. Ici, l'activation du photosensibilisateur entraîne la formation d'un état particulier de la molécule de dioxygène, chimiquement très réactifréactif, et donc très toxiques pour les cellules tumorales. Ces deux thérapies physiques agissent en synergiesynergie sur l'activité des protéinesprotéines impliquées dans l'apoptoseapoptose, la mort programmée de la cellule. Leur association induit ainsi une régression totale de la tumeur alors qu'une seule thérapie ne permet pas de stopper la croissance de cette dernière.
Pour les chercheurs, la prochaine étape consiste à exploiter les autres propriétés magnétiques des liposomes pour améliorer le traitement : les nanoparticules sont, en effet, visibles par IRM et peuvent être déplacées grâce à des aimantsaimants. Il deviendrait ainsi possible, après une injection dans la circulation sanguine, de cibler grâce à des aimants les liposomes vers les tumeurs, tout en cartographiant par IRMIRM leurs destinations finales.
Ces résultats, qui montrent l'importance des thérapies multiples, ont été publiés dans ACS nano le 24 mars 2015.