au sommaire
Un nouvel antibiotique verra-t-il bientôt le jour ? © DR
Alors que pèse la menace d'une pénurie d'antibiotiques efficaces et que les infections de bactéries multirésistantes se multiplient, un nouveau mécanisme naturel de mort bactérienne pourrait devenir une cible de choix pour le développement de nouveaux médicaments. C'est du moins l'avis des scientifiques du Max PlanckMax Planck Institute for Medical Research à Heidelberg, qui ont publié leurs étonnants résultats dans la revue Plos Biology.
Ils se sont intéressés à un mécanisme particulier de suicide bactérien, induit en conditions de stress, un peu comme le font les cellules humaines par apoptose pour protéger le reste de l'organisme d'un possible cancer. Ce mécanisme, observé chez la majorité des bactéries, est régulé par un système toxine-antitoxine.
Un poison et son antidote
Il s'agit d'un duo de gènesgènes placés côte à côte (un opéron) qui codent l'un pour un poison (une toxine) et l'autre pour son antidote (une antitoxine). En temps normal, la synthèse de la toxine à l'intérieur de la cellule bactérienne n'a pas d'effet, si tant est que l'antitoxine (qui inhibe l'action de la toxine en la dégradant ou en empêchant sa production) est synthétisée simultanément. Mais dès que l'antitoxine ne peut plus être produite ou est dégradée, la toxine prend le dessus et provoque des dégâts si importants qu'ils entraînent la mort de la cellule.
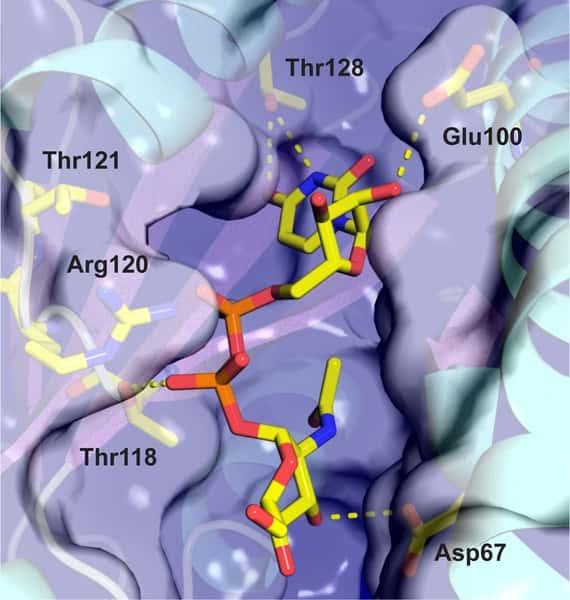
La molécule UNAG entre parfaitement dans le site actif de la toxine PezT pour y être phosphorylée. © Plos Biology
Parmi de tels systèmes, le duo epsilon-zeta (appelé système PezAT pour Pneumococcal epsilon zeta Antitoxin Toxin) est présent chez de nombreuses bactéries pathogènes (streptocoquesstreptocoques, entérocoquesentérocoques) impliquées dans les méningites ou les pneumoniespneumonies. Bien connu depuis une vingtaine d'années, le mécanisme d'action de PezAT restait pourtant encore mystérieux. Pour mieux le comprendre, les scientifiques ont tenté de le décortiquer chez la fameuse bactérie modèle, Escherichia coliEscherichia coli, en lui faisant exprimer artificiellement le gène toxique : PezT.
Les chercheurs ont remarqué que l'induction de l'expression d'une protéineprotéine PezT légèrement mutée (tronquée des onze derniers acides aminésacides aminés), de façon à la rendre moins toxique, induit un défaut de division cellulaire menant au bout d'une heure à une mort massive des bactéries. La forme des cellules en détresse ressemble fortement aux sphéroplastes, des cellules dépourvues de paroi cellulaire, observées lors de leur exposition à un antibiotiqueantibiotique du type β-lactame (pénicillinepénicilline, ampicilline...) qui inhibe la synthèse des peptidoglycanes (les éléments de base de la paroi cellulaire).
La toxine inhibe la formation de la paroi cellulaire
Les scientifiques ont alors supposé que la toxine devait avoir une action similaire... et ont eu raison ! En effet, ils ont pu prouver que la toxine PezT empêche la formation de la paroi en induisant la phosphorylationphosphorylation de l'UNAG (l'uridine diphosphate-N-acétylglucosamine) en UNAG-3P. Cette subtile modification prend tout son sens dans la cellule, car UNAG, qui participe de près à la constructionconstruction des parois cellulaires, n'a pas les mêmes propriétés que son homologue modifié. UNAG-3P s'accumule alors dans la cellule de façon stable et devient toxique en inhibant les enzymesenzymes bactériennes impliquées dans la construction de la paroi, qui utilisent en temps normal la moléculemolécule UNAG.
Selon les auteurs de l'article, la découverte des propriétés de l'UNAG-3P est un premier pas qui permet d'espérer le développement de molécules à but thérapeutique qui mimeraient son mode d'action. Une nouvelle classe d'antibiotiques pourrait alors bientôt faire surface, et serait d'ailleurs plutôt bienvenue...