au sommaire

L’usine de traitement des eaux Hyperion à Los Angeles, située juste à côté de la mer. Tout ce qu’il faut pour en faire une installation de production d’hydrogène. © dsearls, CC by-nc-sa 2.0
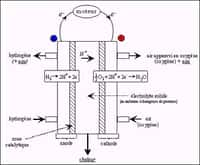
« Ce système peut produire de l'hydrogènehydrogène partout où il y a de l'eau sale à proximité d'eau de mer » : c'est ainsi que Bruce Logan, de l'université de Pennsylvanie (PennState University) résume les possibilités de ses MREC, pour Microbial Reverse-electrodialysis Electrolysis Cell, traduisible par cellule d'électrolyseélectrolyse par électrodialyse inverse microbienne. L'idée est de réaliser une hydrolysehydrolyse (qui casse les moléculesmolécules d'eau) pour produire de l'hydrogène gazeux - lequel est un bon vecteur d'énergieénergie - en utilisant une double source d'électricité produite gratuitement : l'électrodialyse inverse et... des bactériesbactéries.
Il existe effectivement des bactéries qui rejettent des électronsélectrons quand elles mangent. Bruce Logan s'intéresse à l'utilisation des eaux usées depuis 2004 et avait décrit en 2005 une version biologique de la pile à combustible, dans laquelle de la matièrematière organique est dégradée dans un compartiment peuplé de bactéries, et capable de produire - un peu - d'électricité. Ce principe est celui de la pile à combustiblepile à combustible microbienne, ou MFC (Microbial FuelFuel Cell), à distinguer de la pile à combustible au sens classique, qui, elle, consomme de l'hydrogène (et l'oxygène de l'airair) pour générer de l'électricité. Mais la production d'une MFC est trop faible pour une hydrolyse. L'idée existe de produire de l'hydrogène par ce moyen, mais il faut une source d'électricité complémentaire, donc externe. « Les travaux précédents montrent que de tels systèmes peuvent générer 0,3 voltvolt par cellule alors qu'il en faut 0,414 pour une hydrolyse », précisent les chercheurs.

L'appareillage installé dans le laboratoire de Bruce Logan, à la PennState University, produit bien de l'hydrogène. Mais il est encore loin, très loin, d'un modèle commercialisable. © Bruce Logan et al.
Faire du courant avec de l’eau
Quant à l'électrodialyse, c'est un procédé connu pour extraire les ionsions d'un liquideliquide (par exemple le sel de l'eau de mer) à l'aide d'un courant électriquecourant électrique. Avec un jeu de membranes ne laissant passer que les ions positifs pour les unes et les négatifs pour les autres, on parvient ainsi, par exemple, à dessaler l'eau de mer. Peu efficace, la méthode n'est guère prisée. La réaction inverse est possible : avec deux sources d'eau de salinitéssalinités différentes traversant des membranes alternativement positives et négatives, on peut produire de l'électricité. De l'eau douce et de l'eau de mer peuvent ainsi devenir un générateurgénérateur d'électricité. Mais là encore, le résultat est médiocre et insuffisant pour une hydrolyse. Il faudrait 25 paires de membranes pour obtenir la tension de 1,8 volt nécessaire pour y parvenir, expliquent les chercheurs, ce qui ruinerait la rentabilité de l'appareil à cause de la puissance consommée par le pompage de l'eau.
L'idée du professeur Logan a été d'additionner ces deux méthodes. Des bactéries nourries de matières organiques, par exemple des eaux uséeseaux usées, produisent du courant électrique, lequel est complété par celui issu de l'électrodialyse inverse. « Il suffit d'ajouter de l'eau douce, de l'eau salée et quelques membranes » explique Bruce Logan.
Une technique à mettre au point
Dans la description du dispositif exposé dans la revue Pnas, l'équipe annonce des résultats modestes mais réels. Leur appareil produit 0,8 à 1,6 mètre cube d'hydrogène gazeux par jour pour 1 mètre cube d'eau utilisé. Le rendement est compris entre 58 et 64 % avec les systèmes testés. Ils utilisent des électrodesélectrodes en platineplatine, ce qui grève considérablement le coût du procédé. Mais les chercheurs américains sont persuadés qu'un matériaumatériau moins onéreux pourrait convenir. Ils citent le sulfuresulfure de molybdènemolybdène, qui ne descendrait le rendement que jusqu'à 50 %.
Le procédé, de plus, reste complexe, et est loin d'être au point. Mais il semble astucieux et même prometteur. Produire localement de l'hydrogène à partir d'eaux usées ou de déchets organiques pour charger des piles à combustibles alimentant des moteurs électriques : voilà une idée qui mérite sans doute d'être creusée...