au sommaire
Les télomères sont situés aux extrémités des chromosomes, et raccourcissent au fil des divisions cellulaires. © UBC, Université de la Colombie-Britannique
Les extrémités de chromosomes, les télomères, sont répliquées à chaque division cellulaire par une enzymeenzyme, la télomérase. Leur position au bout de la moléculemolécule d'ADN rend difficile leur réplication, qui se fait mal, et mène au raccourcissement des télomères à chaque cycle. Puisqu'ils sont constitués de séquences d'ADN répétées, aucun gène essentiel n'est perdu. Pourtant, de nombreuses études indiquent le lien entre la diminution de leur longueur et le vieillissement ou le cancercancer. Le raccourcissement excessif mène d'ailleurs à la mort cellulaire. Une nouvelle étude montre que ces télomères pourraient même servir de marqueur pour sélectionner les meilleurs embryons fécondés in vitro.
L'étude publiée dans le journal Molecular Human Reproduction s'est focalisée sur la longueur des télomères dans les embryonsembryons issus de fécondation in vitro. Les chercheurs ont utilisé la méthode de Q-FISH (quantitative fluorescence in situ hybridization). Cette technique utilise un morceau d'ADN couplé à une molécule fluorescente. Ces deux partenaires constituent la sonde, déposée sur les cellules d'intérêt. Grâce à la complémentarité de séquences, la sonde peut se fixer sur l'ADN cellulaire. A l'aide d'un laserlaser, il est possible de quantifier précisément le signal fluorescent : plus le signal est fort, plus la quantité d'ADN qui s'est fixé est grande, et donc plus le télomère est long. Il est possible de corréler le signal à une longueur, mesurée en paires de bases (l'unité de l'ADN).
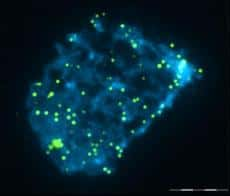
Image prise au microscope à épifluorescence du noyau (bleu) d'une cellule traitée au Q-FISH. Chaque point vert représente un télomère (la barre d'échelle représente 4 micromètres). © Molecular Human Reproduction
Le yoyo des télomères
Les chercheurs de l'équipe du Warwick Medical School à l'Université de Warwick et de l'University Hospital Coventry ont mis à profit cette technique pour mesurer les télomères à différents stades de développement d'embryons issus de fécondation in vitro et restés inutilisés.
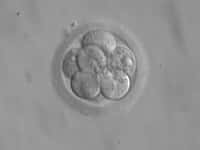
Lors du développement de l'embryon, différents stades se succèdent : d'abord le stade oocyte, qui est la cellule-mère non encore fécondée, puis le stade de la segmentation, où se produisent de nombreuses divisions cellulaires juste après la fécondation, et enfin le stade blastocysteblastocyste où les différents feuillets (qui donneront les organes) se différencient.
De manière surprenante, les chercheurs ont réussi à montrer que la longueur des télomères n'est pas décroissante, mais qu'elle se régénère au cours du développement de l'embryon. Ainsi, la longueur des télomères diminue entre le stade oocyte (11,12 kilobaseskilobases) et le stade de segmentation (8,43 kilobases) mais augmente au stade blastocyste (12,22 kilobases). D'autres méthodes de calcul de la longueur ont montré les mêmes tendances. Cette découverte est étonnante et les chercheurs ont d'ailleurs du mal à expliquer la logique de ce mécanisme.
Quoiqu'il en soit, les chercheurs ont maintenant des données chiffrées pour déterminer la longueur des télomères qui conduisent à un développement viable de l'embryon. Elles pourront peut-être permettre de prévoir la viabilité des embryons issus de fécondation in vitro, afin de sélectionner ceux qui ont le plus de chances de survivre in utero.