au sommaire
Entre deux fréquences et
, caractérisant des raies dans le spectre de l'atome d'hydrogène, existe lorsqu'on fait leur soustraction la formule de Balmer (du nom de son découvreur) suivante :
n et m étant des entiers non nuls, la constante de Rydberg, et c la vitesse de la lumière.
C'est la fréquence correspondant au photonphoton émis ou absorbé lors d'une transition atomique pour un électronélectron entre deux niveaux principaux d'énergiesénergies caractérisés par les nombres quantiquesnombres quantiques n et m.

Johann Jacob Balmer (1825-1898).
En fait Johann Balmer avait étudié la série de raies spectralesraies spectrales de l'atome d'hydrogène telle que m=2. Il existe d'autres séries de transition comme la fameuse série de Lyman importante en cosmologiecosmologie.
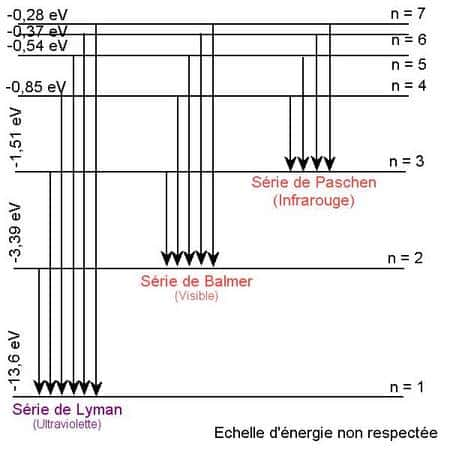
Séries spectrales de l'atome d'hydrogène ; attention, ici le n correspond au m de la formule précédente.
Crédit : Olivier Thizy